14. IDENTIFICAÇÃO DE ENTEROBACTÉRIAS
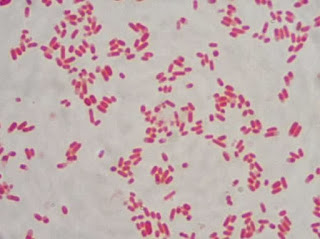 |
| Bastonetes Gram-negativos isolados. Família Enterobacteriaceae / Não produtores da enzima citocromo-oxidase Fonte: http://microvetuece.blogspot.com.br/ |


IDENTIFICAÇÃO DE ENTEROBACTÉRIAS
(Microbiologia Básica / Profa . Zilka Nanes Lima)
Creative Commons* ZILKA NANES LIMA(2023). Atribuição-NãoComercial-SemDerivações.
1. Conceito:
Enterobactérias pertencem a família Enterobacteriaceae, sendo bacilos Gram-negativos variando de curtos a médios, fermentadores da glicose com ou sem produção de gás, catalase positivos, reduzem o nitrato a nitrito e são oxidase negativos (exceção: Pleisomonas shigeloides).
São divididos através de diferentes provas em 11 gêneros, tendo sido descritos nos últimos anos outros 16 gêneros e algumas espécies, mas ainda consideradas de pouca ou nenhuma importância clínica.
2. Identificação
inicial de enterobactérias:
Elas crescem em meios não seletivos
ricos como o ágar sangue, ágar chocolate e ágar CLED, meios de enriquecimento
(caldo BHI, caldo nutriente), meios seletivos (ágar Mac Conkey, ágar BEM, ágar
SS), e não crescem em meios seletivos para Gram-positivos (ágar manitol
salgado, ágar sangue acrescido de azida).
O primeiro passo a ser dado é realizar o
gram das colônias. Confirmando-se tratar de bastonetes Gram-negativos, realizar
o teste da oxidase, este teste sendo negativo possivelmente estaremos diante de
uma enterobactéria, precisando ainda confirmar a fermentação da glicose.
Realizar então os testes bioquímicos.
A melhor maneira de conseguir a melhor
morfologia bacterioscópica é cultivar o microrganismo em estudo no caldo
tioglicolato.
As características morfológicas que as colônias apresentam em ágar Mac Conkey,
ágar EMB e ágar CLED, são importantes para a identificação inicial (vide tabela
1). Estas características se tornam mais evidentes com 48 horas de incubação.
Tabela 1 - Características morfológicas das colônias de algumas enterobactérias
Micro-organismo
|
Tamanho / Odor
|
Borda ou
forma
|
Elevação
|
Densidade
|
Cor
|
Consistência/ Aparência
|
Hemólise em AS
|
Escherichia coli
| Médio / Vinagre | Circular | Achatada | Opaca |
Cinza (AS)
Rosa (MC)
Rosa a marrom (EMB) | Seca | Em geral beta |
Enterobacter spp.
|
Médio
/Fermento de pão
|
Circular
|
Convexa
|
Opaca
|
Cinza(AS)
Rosa(MC)
Rosa a marrom (EMB) |
Levemente
mucóide
|
Sem hemólise
|
Citrobacter spp.
|
Médio/
Característico |
Circular
|
Convexa
|
Opaca
|
Esbranquiçada (AS)
Esbranquiçada(MC)
Esbranquiçada (EMB) |
Lev.mucóide.
|
Sem hemólise
|
Klebsiella spp.
|
Grande
/Fermento de pão
|
Circular
|
Convexa
|
Opaca
|
Cinza(AS)
Rosa(MC)
Rosa a marrom (EMB) |
Mucóide
|
Sem hemólise
|
Morganella morganii
|
Médio
/Fétido
|
Ondulada
|
Achatada
|
Translúcida
|
Incolor (MC)
Incolor (EMB) |
Brilhante
|
Sem hemólise
|
Salmonella spp.
|
Pequeno
/Fétido
|
Circular
|
Convexa
|
Translúcida
|
Centro preto(SS)
Incolor(MC)
Incolor (EMB) |
Brilhante
|
Sem hemólise
|
Serratia spp.
|
Médio
/Fermento de pão
|
Circular
|
Convexa
|
Opaca
|
Cinza(AS)
Clara(MC)
Clara (EMB) |
Levemente
mucóide
|
Sem hemólise
|
Providencia spp.
|
Médio
/Fétido
|
Ondulada
|
Achatada
|
Translúcida
|
Incolor (MC)
Incolor (EMB) |
Brilhante
|
Sem hemólise
|
Proteus spp.
|
Médio
/Fétido
|
Ondulada
|
Achatada
|
Translúcida
|
Incolor (MC)
Incolor (EMB) |
Brilhante
|
Sem hemólise
|
Shigella spp.
|
Pequeno/
Característico |
Circular
|
Convexa
|
Translúcida
|
Incolor (MC)
Incolor (EMB) Incolor (SS) |
Brilhante
|
Sem hemólise
|
| Edwardsiella tarda |
Pequeno/ Característico
|
Circular
|
Convexa
|
Translúcida
|
Incolor (MC)
Incolor (EMB)
Incolor (SS)
|
Brilhante
|
Sem hemólise
|
AS= Agar sangue; MC=Agar MacConkey; SS= Agar Salmonella-Shigella;
Tamanho das colônias (mm) : Grande = maior que 1 mm de diâmetro (Ex: Klebsiella pneumoniae)
Média = 1 mm de diâmetro (Ex: Enterococcus faecalis)
Pequena = menor que 1 mm de diâmentro (Ex: Streptococcus pyogenes)
Fonte: Oplustil et al., 2010 (com modificações feitas pela autora)
Fonte: Oplustil et al., 2010 (com modificações feitas pela autora)
--------------------------------------------------------------------------------------------------------------------------
Página em construção
A PARTIR DAQUI O TEXTO ESTARÁ "CONTROL C, CONTROL V" DA APOSTILA DA AULA PRÁTICA, QUE ESTÁ INACABADA. TEM SÍMBOLOS QUE AQUI NÃO FICAM CONFIGURADOS COMO NO WORD.(Adicionei em Outubro de 2019 as fotos).
3.Provas
bioquímicas e meios de cultura para a identificação de enterobactérias:
Inocular os
meios de cultura em tubo com estilete ou agulha de inoculação.
A).Citrato de
Simmons (“risco” de um lado a outro ou estria por cima) – PRIMEIRO
B). TSI
(Triplice Sugar Iron) – (picada até o final e estria por cima)
C). LIA (Lisina
Iron Agar) – (duas picadas até o final e estria por cima)
D) EPM (Escola
Paulista de Medicina) – (picada até o fundo e estria por cima)
E) SIM
(Sulfeto de hidrogênio, Indol, Motilidade)- (picada até 2/3)
F). MIO
(Moltilidade Indol Ornitina) – (picada até 2/3)
G). MILI
(Motilidade Indol Lisina) – (picada até 2/3)
H).
Fenilalanina (estria por cima)
I). Uréia de
Christensen - (em caldo – colocar um pouco da colônia com estilete ou alça)
J) Caldo
malonato – (colocar um pouco da colônia com estilete ou alça)
L). MR-VP
(para Vermelho de Metila) - (colocar um pouco da colônia com estilete ou alça)
M). MR- VP
(para Voges Proskauer) – (colocar um pouco da colônia com estilete ou alça)
Outros testes
que podem ser usados também para identificar enterobactérias:
N). Agar
esculina – (estria por cima)
O) DNAse
(fazer um círculo com a alça ou palito estéril na superfície do meio de
cultura) – incubar à temperatura ambiente.
P) Lipase
(fazer um círculo com alça ou palito estéril na superfície do meio de cultura)
– incubar à 36ºC.
Q) Pigmento
produzido em ágar Mueller Hinton
-------------------------------------------------------------------------------------------------------------------------------
SEQUÊNCIA PARA IDENTIFICAÇÃO DE ENTEROBACTÉRIAS
I.Analisar a
morfologia das colônias bacterianas nos diversos meios de cultura. Em especial
no ágar MacConkey.
II.Realizar o
Gram das colônias crescidas por 24 horas em meios de cultura.
III. OXIDASE
(citocromo oxidase).
Citocromo-oxidase é uma enzima do grupo das ferroporfirinas. As bactérias que produzem esta enzima apresentam um sistema de transporte de elétrons, denominado SISTEMA CITOCROMO-OXIDASE. Neste sistema, os aceptores eletrônicos naturais podem ser substituídos por substratos artificiais, que, na presença de oxigênio atmosférico, são oxidados pela citocromo oxidase formando um composto colorido.
Citocromo-oxidase é uma enzima do grupo das ferroporfirinas. As bactérias que produzem esta enzima apresentam um sistema de transporte de elétrons, denominado SISTEMA CITOCROMO-OXIDASE. Neste sistema, os aceptores eletrônicos naturais podem ser substituídos por substratos artificiais, que, na presença de oxigênio atmosférico, são oxidados pela citocromo oxidase formando um composto colorido.
Investigar, independentemente, as
colônias individuais crescidas sobre o meio de cultura (ou no caso de cultivos
puros). Melhor usar colônias do ágar Mac Conkey quando lactose negativas e de
outro meio quando lactose positivas. Colocar o microrganismo na zona de reação
e analisar por cerca de · 20-60 segundos. No caso de bactérias
citocromo-oxidase (+), a zona de reação apresenta uma coloração azul-violeta.
IV.Realizar a
prova de fermentação da glicose
PS: Como esta prova precisar de 1 dia de incubação para conclusão do resultado, sugiro a realização da
bateria mínima de testes para identificação das enterobactérias mais
freqüentemente isoladas nas culturas bacteriológicas.
- Para
utilização do sistema numérico: EPM, MILI, CITRATO (e o resultado da lactose em
placa de ágar MacConkey). Eu também adiciono TSI (confirmando a fermentação da
glicose e da lactose e a produção de CO2).
- Para
utilização da identificação tradicional: CITRATO, TSI, MILI, URÉIA, em colônias
lactose negativas em meios indicadores adicionar FENILALANINA. Caso não tenha
MILI utilizar LIA e SIM.
- Sobre as imagens que seguem: Para comparar os resultados das provas bioquímicas de enterobactérias com um bastonete Gram-negativo não fermentador (BGNNF), a Pseudomonas aeruginosa foi a escolhida, já que este é o BGNNF mais frequentemente isolado em Microbiologia Clínica.
- Sobre as imagens que seguem: Para comparar os resultados das provas bioquímicas de enterobactérias com um bastonete Gram-negativo não fermentador (BGNNF), a Pseudomonas aeruginosa foi a escolhida, já que este é o BGNNF mais frequentemente isolado em Microbiologia Clínica.
A). CITRATO DE SIMMONS:
Ø Determinar se o microrganismo é capaz
de utilizar o citrato como única fonte de carbono em seu metabolismo com
resultante alcalinidade do meio de cultura.
N Deve ser o primeiro dos tubos a ser
inoculado, ou então o estilete flambado antes de se pegar a colônia para evitar
contaminação de substâncias de outros meios de cultura.
· Incubar 24 horas/ 35oC.
Interpretação:
Citrato positivo = azul e/ou crescimento no meio
Citrato
negativo = cor verde (inalterado)
B). TRíPLICE
SUGAR IRON (TSI):
Ø Determinar se o micro-organismo é capaz
de fermentar os açucares glicose, lactose e sacarose, se forma gás carbônico a
partir de glicose e se produz sulfeto de hidrogênio (H2S).
N O meio TSI é inclinado em bico de
flauta, de cor vermelho-cereja e deve ser inoculado por picada central até o
fundo, seguido de espalhamento na superfície.
· Incubar 18 - 24 horas/ 35oC.
Interpretação:
a) Púrpura / amarelo (ápice púrpuro ESCURO e base amarelada)
= fermentação apenas da glicose (lactose e sacarose negativas)
b) Púrpura / amarelo (ápice púrpuro CLARO e base amarelada) =
fermentação apenas da glicose (lactose ou sacarose negativa). PS: Se a lactose
é positiva em meio indicador o teste geralmente se repete em tubo, neste caso
ápice púrpuro claro indica apenas sacarose negativa.
c) Amarelo/ amarelo (ápice e base amarelos) = fermentação da
glicose + lactose + sacarose
d) Presença de gás (CO2) = bolhas ou o meio fragmentado
e) H2S
positivo = presença de precipitado negro
 |
| Figura 2.b - Ágar TSI Fonte: https://microbiologylabnotes.blogspot.com/ |
C). LIA
(Lisina Iron Agar)
Ø Testa a habilidade de um microrganismo
em produzir lisina descaboxilase, lisina desaminase, sulfeto de hidrogênio (H2S) e dióxido de carbono.
N Introduzir o estilete até o fundo do
tubo 2 vezes, uma mais a frente e outra mais atrás seguido de espalhamento por
estria na superfície inclinada.
· Incubar por 24 horas à 35oC
Interpretação:
_ Lisina
descarboxilase (+) - meio permanece roxo (ou roxo acinzentado ou roxo mais
escuro)
_ Lisina
descarboxilase (-) 2/3 inferiores mudam para o amarelo
_ Lisina
desaminase (+) – cor vermelha no ápice
_ Lisina
desaminase (-) – ápice permanece da mesma cor
_ H2S (+) –
precipitado negro
_ H2S (-) –
ausência de precipitado negro
- Presença de gás (CO2) = bolhas ou o meio fragmentado
Um reação
negativa (superfície inclinada do ágar roxo e base amarela) indica apenas a
fermentação da glicose.
D)EPM (Escola
Paulista de Medicina)
Ø Contém os testes de fermentação e
produção de gás a partir da glicose, produção de CO2 , sulfeto de hidrogênio (H2S),
hidrólise da uréia e desaminação do L-triptofano (LTD).
LTD: Detecção
do L-triptofano a ácido indolpirúvico
N Introduzir o estilete até o fundo do
tubo seguido de espalhamento por estria na superfície inclinada.
· Incubar por 24 horas à 35oC
Interpretação:
- Produção de
gás: aparecimento de bolhas ou deslocamento do meio de cultura do fundo do
tubo.
- Produção de
H2S: enegrecimento do meio em qualquer
intensidade
- Hidrólise da
uréia: aparecimento de cor azul ou verde azulada (reação fraca) que se estende
para a base do meio, envolvendo-a totalmente ou não.
- Desaminação
do L-triptofano: aparecimento de cor verde-garrafa na superfície do meio.
 |
| Figura 4.a - Meio EPM (a esquerda) e MILI (a direita) Fonte: https://www.netlabshop.com.br |
 |
| Figura 4.b - Meios inoculados e incubados: ágar TSI (a esquerda) e EPM (a direita) Fonte: https://www.biomedicinatotal.com.br/ |
E). SIM
(Sulfeto de hidrogênio - Indol - Motilidade)
Ø Informa sobre motilidade, indol e
sulfeto de hidrogênio.
N Introduzir o estilete até 2/3 do meio
(este meio deve preencher 1/3 da capacidade do tubo)
· Incubar por 24 horas à 36oC
Interpretação:
_ Motilidade
(+) – Crescimento além do local da inoculação (meio turva)
_ Motilidade
(-) – Crescimento apenas no local da inoculação
_ H2S (+) –
precipitado negro (forma-se sulfato de ferro)
_ H2S (-) –
ausência de precipitado negro
Para a leitura
do Indol, adicionar 2 gotas de Reativo de Kovacs (q
_Indol (+) –
reativo muda para a cor rosa no primeiro minuto
- Indol (-) –
reativo não muda de cor
 |
Figura 5.c - SIM (Sulfeto de hidrogênio - Indol - Motilidade)
ANTES DE INOCULAR O REAGENTE DE KOVACS
Escherichia coli (EC) e Klebsiella pneumoniae (KP)
|
 |
Figura 5.d - SIM (Sulfeto de hidrogênio - Indol - Motilidade)
DEPOIS DE INOCULAR O REAGENTE DE KOVACS
Escherichia coli (EC) e Klebsiella pneumoniae (KP)
|
 |
Figura 5.e - SIM (Sulfeto de hidrogênio - Indol - Motilidade)
DEPOIS DE INOCULAR O REAGENTE DE KOVACS
Serratia liquefaciens (SL) e Morganella morganii (MM)
|
 |
Figura 5.f - SIM (Sulfeto de hidrogênio - Indol - Motilidade)
ANTES DE INOCULAR O REAGENTE DE KOVACS
Morganella morganii (MM) com motilidade positiva e com pouca produção de ácido sulfídrico (H2S).
|
 |
Figura 5.g - SIM (Sulfeto de hidrogênio - Indol - Motilidade)
ANTES DE INOCULAR O REAGENTE DE KOVACS
Morganella morganii (MM) com motilidade positiva e com pouca produção de ácido sulfídrico (H2S).
|
 |
Figura 5.h - SIM (Sulfeto de hidrogênio - Indol - Motilidade)
DEPOIS DE INOCULAR O REAGENTE DE KOVACS
3 isolados diferentes de Escherichia coli (EC)
|
Preparo do Reativo de Kovacs:
p-dimetilamino
benzaldeído . . . . 5 g
Metanol . . .
. . . . . . . . . . . . . . . . 50 ml
Acido
orto-fosfórico . . . . . . . . .10 mL
F). MIO (Motilidade, Indol, Orinitina)
Ø Informa sobre motilidade, indol e a
descaborxilação da ornitina.
N Introduzir o estilete até 2/3 do meio
(este meio deve preencher 1/3 da capacidade do tubo)
· Incubar por 24 horas à 36oC
Interpretação:
_ Motilidade
(+) – Crescimento além do local da inoculação (meio turva)
_ Motilidade
(-) – Crescimento apenas no local da inoculação
_ Ornitina
descarboxilase (+) - meio permanece roxo (ou roxo acizentado ou mais escuro)
_ Ornitina
descarboxilase (-) 2/3 inferiores mudam para o amarelo
Para a leitura
do Indol, adicionar 2 gotas de Reativo de Kovacs
_ Indol (+) –
reativo muda para a cor rosa no primeiro minuto
- Indol (-) –
reativo não muda de cor
 |
Figura 6.e - LIA (Lisina - Indol - Ornitina descarboxilase)
DEPOIS DE INOCULAR O REAGENTE DE KOVACS
Escherichia coli (EC) e Klebsiella pneumoniae (KP)
|
 |
Figura 6.f - LIA (Lisina - Indol - Ornitina descarboxilase)
DEPOIS DE INOCULAR O REAGENTE DE KOVACS
Morganella morganii (MM) e Serratia liquefaciens (SL)
|
 |
Figura 6.g - LIA (Lisina - Indol - Ornitina descarboxilase)
DEPOIS DE INOCULAR O REAGENTE DE KOVACS
3 isolados diferentes de Escherichia coli (EC)
|
G). MILI
(Motilidade, Indol e Lisina descarboxilase)
Ø Informa sobre motilidade, indol e a
descaborxilação da lisina.
N Introduzir o estilete até 2/3 do meio
(este meio deve preencher 1/3 da capacidade do tubo)
· Incubar por 24 horas à 36oC
Interpretação:
_ Motilidade
(+) – Crescimento além do local da inoculação (meio turva)
_ Motilidade
(-) – Crescimento apenas no local da inoculação
_ Lisina
descarboxilase (+) - meio permanece roxo (ou roxo acizentando ou mais escuro)
_ Lisina
descarboxilase (-) 2/3 inferiores mudam para o amarelo
Para a leitura
do Indol, adicionar 2 gotas de Reativo de Kovacs
_ Indol (+) –
reativo muda para a cor rosa no primeiro minuto
- Indol (-) –
reativo não muda de cor
Informação
adicional sobre a produção de indol: As enterobactérias podem produzir a enzima
triptofanase e, quando semeadas em meios contendo triptofano (SIM, MIO e MILI)
produzem indol, além de também produzirem na mesma reação amônia e piruvato
(ácido pirúvico). Sendo o indol um produto da degradação imediata do triptofano
com adição do reativo de Kovacs (que contém p-dimetilaminobenzaldeído)
resultando em cor rosa avermelhado.
 |
| Figura 7 - Meio MILI (Motilidade-Indol-Ornitina) Fonte: http://www.brasilcientificashop.com/ |
H). Agar Fenilalanina
Ø Testa a habilidade da FAD
(fenilalanina desaminase) em desaminar oxidativamente a fenilalanina presente
no meio de cultura formando ácido fenilpirúvico que em presença de cloreto
férrico produz uma cor verde garrafa no reagente.
N Estria por cima da superficie
inclinada do meio
· Incubar por 24 horas à 35oC
Interpretação:
Após
crescimento pingar 3 gotas do reagente cloreto férrico a 10%
_ Fenilalanina
(+) – cor verde escuro na superfície
_ Fenilalanina
(-) – mantém a cor inalterada
 |
Figura 8.a - FEN (ágar Fenilalanina)
ANTES DE INOCULAR O CLORETO FÉRRICO
O tubo da esquerda não foi inoculado
Escherichia coli (EC)
Klebsiella pneumoniae (KP)
Serratia liquefaciens (SL)
Morganella morganii (MM)
BGNNF - Pseudomonas aeruginosa (PA) |
 |
Figura 8.b - FEN (ágar Fenilalanina)
DEPOIS DE INOCULAR O CLORETO FÉRRICO
O tubo da esquerda não foi inoculado
Escherichia coli (EC)
Klebsiella pneumoniae (KP)
Serratia liquefaciens (SL)
Morganella morganii (MM)
BGNNF - Pseudomonas aeruginosa (PA) |
I). Ágar Uréia de Christensen ou caldo uréia:
Ø Detecção da enzima urease.
N Estria por cima com inóculo pesado na
superficie inclinada do meio, ou inóculo pesado no caldo.
· Incubar por 24 horas à 35oC
Interpretação:
_ Urease (+) –
desenvolvimento de cor rósea-púrpura de qualquer intensidade
_ Urease (-) –
mantém a cor inalterada do meio
 |
Figura 9 - URE (ágar Uréia de Christensen)
O tubo da esquerda não foi inoculado
Escherichia coli (EC)
Klebsiella pneumoniae (KP)
Serratia liquefaciens (SL)
Morganella morganii (MM)
BGNNF - Pseudomonas aeruginosa (PA) |
J) Caldo
Malonato
Ø Determinar se o microrganismo é capaz
de utilizar o malonato como única fonte de carbono em seu metabolismo com
resultante alcalinidade do meio de cultura.
N Semear o microrganismo em estudo (com
inoculo leve) em caldo dissolvendo o inoculo na parte superior do caldo.
· Incubar 24 horas/ 35oC.
Interpretação:
Malonato positivo = meio muda para azul
Malonato
negativo = cor verde (inalterado)
 |
Figura 10 - MAL (caldo Malonato)
O tubo da esquerda não foi inoculado
Escherichia coli (EC)
Klebsiella pneumoniae (KP)
Serratia liquefaciens (SL)
Morganella morganii (MM)
BGNNF - Pseudomonas aeruginosa (PA) |
L). VERMELHO
DE METILA (VM):
Ø Testa a habilidade de um
microrganismo em produzir e manter estáveis produtos finais ácidos a partir da
fermentação da glicose, superando a capacidade de tamponamento do sistema.
Ocorre uma fermentação ácida mista (ácido fórmico, acético, láctico e
succínico).
N Semear o microrganismo em estudo (com
inoculo leve) em caldo MR-VP (com quantidade de meio equivalente a 1/3 da
capacidade do tubo).
· Incubar por no mínimo 48 horas (até 5
dias)/ 35-37oC
Interpretação:
- Adicionar 5
gotas da solução de vermelho de metila ao tubo contendo o crescimento
bacteriano de, no mínimo, 48 horas. Interpretar a cor resultante imediatamente.
a) Teste (+): formação de cor vermelha na superfície do meio
(pH≤4,4)
b) Teste(-):
coloração amarela no meio de cultura (pH≥6,0)
Preparo do Reativo Vermelho de Metila:
Vermelho de Metila . . . . . . . . . . . . .0,1 g
Etanol . . . . . . . . . . . . . . . . . . . . . . 60 mL
Água destilada . . . . . . . . . . . . . . .100 mL
M).
VOGES-PROSKAUER (VP):
Ø Testa a habilidade do microrganismo fermentar, por via butilenoglicólica, a glicose com produção de acetil-metil-carbinol (acetoína), butilenoglicol e pequenas quantidades de ácidos carboxílicos, superando a capacidade de tamponamento do sistema. Com a adição de hidróxido de potássio em presença do oxigênio da atmosfera, a acetoína converte-se em diacetila e com a adição de alfa-naftol ocorre a catálise com a produção de um característico anel de cor vermelho-cereja, enquanto que uma cor amarelo-acastanhada indica um resultado negativo.
N Semear o microrganismo em estudo (com
inoculo leve) em caldo MR-VP (com quantidade de meio equivalente a 1/3 da
capacidade do tubo).
· Incubar por no mínimo 48 horas (até 5
dias)/ 35-37oC
Interpretação:
- Adicionar
0,2 mL de KOH 40% (ou NaOH 40%) e 0,6 mL de solução de α-naftol 5%.
Agitar bem e
esperar 10 minutos.
c) Teste (+): caldo com coloração vermelha
d) Teste(-):
caldo com coloração amarela
Preparo do Reativo α-naftol alcóolico:
α-natol . . . . . . . . . . . . . . . . . . . . . . . 5 g
Etanol . . . . . . . . . . . . . . . . . . . . . . 100 mL
Preparo do reativo KOH 40%:
Hidróxido de potássio . . . . . . . . . . 40 g
Água. . . . . . . . . . . . . . . . . . . . . . . 100 mL
N). Ágar Bile Esculina:
Ø Demonstra a capacidade do
microrganismo hidrolisar a esculina resultando em coloração enegrecida do meio
de cultura.
N Estria por cima na superficie
inclinada do meio.
· Incubar por 24 horas à 35oC
Interpretação:
_ Esculina (+)
– desenvolvimento de cor negra de qualquer intensidade no meio
_ Esculina (-)
– mantém a cor inalterada do meio
O). Ágar
DNAse:
Ø Detecção da enzima DNAse.
N Inóculo circular numa parte da
superficie do meio.
· Incubar por 24 horas à temperatura
ambiente.
Interpretação:
Meio sem corante (após incubação, inundar a
superfície do meio com HCl 1N).
Esperar o DNA
precipitar
_ DNAse (+) –
halo ao redor do inóculo
_ DNAse (-) –
ausência de halo ao redor do inóculo
Meio com
corante (azul de orto toluidina)
_ DNAse (+) –
coloração rósea ao redor do inóculo
_ DNAse (-) –
ausência de cor rósea ao redor do inóculo
 |
Figura 11.a - ágar DNAse
ANTES DE ADICIONAR O HCl
O tubo da esquerda não foi inoculado
Escherichia coli (EC)
Klebsiella pneumoniae (KP)
Serratia liquefaciens (SL)
Morganella morganii (MM)
BGNNF - Pseudomonas aeruginosa (PA) |
 |
Figura 11.b - ágar DNAse
DEPOIS DE ADICIONAR O HCl
O tubo da esquerda não foi inoculado
Escherichia coli (EC)
Klebsiella pneumoniae (KP)
Serratia liquefaciens (SL)
Morganella morganii (MM)
BGNNF - Pseudomonas aeruginosa (PA) |
Referências:
FALTA ADICIONAR TODAS AS REFERÊNCIAS











Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!