10. CURVA DE CRESCIMENTO BACTERIANO
 |
| Fonte: www.bioneogenios.blogspot.com.br/ |
CURVA DE
CRESCIMENTO BACTERIANO
(Microbiologia Básica / Profa . Zilka Nanes Lima)
ZILKA NANES LIMA 2025
- INTRODUÇÃO:
As
bactérias reproduzem-se por fissão binária (figura 1), processo em que uma célula parental
divide-se, originando duas células-filhas. Pelo fato de uma célula originar
duas células-filhas, é referido que as bactérias realizam crescimento
exponencial (crescimento logarítimico). O conceito de crescimento exponencial
pode ser ilustrado pela seguinte relação:
Número de células: 1 2 4 8 16 32
64 128 256
Exponencial: 20 21 22 23
24 25
26 27
28
Assim,
uma célula bacteriana produzirá 16 novas células após 4 gerações; e 256 novas
células após 8 gerações.
Figura 1 - Bactérias se dividem por fissão binária ou cissiparidade.
 |
| Fonte:Bersek |
O
tempo de duplicação (geração) das bactérias varia de somente 20 minutos , no
caso de Escherichia coli, a mais de
24 horas, no caso de Mycobacterium
tuberculosis. O crescimento exponencial e o tempo curto de duplicação de
alguns organismos resultam na rápida geração de grande número de bactérias. Por
exemplo, um organismo de E. coli
originará uma progênie superior a 1000 em aproximadamente três horas, e acima
de um milhão em cerca de sete horas. O tempo de duplicação varia não somente em
relação à espécie, mas também de acordo com a quantidade de nutrientes,
temperatura, pH e outros fatores ambientais.
O
ciclo de crescimento de bactérias apresenta quatro fases principais. Se um
pequeno número de bactérias for inoculado em um meio nutriente líquido,
realizando-se contagem de bactérias a intervalos frequentes, as fases típicas
de uma curva de crescimento padrão podem ser demonstradas (figura 2):
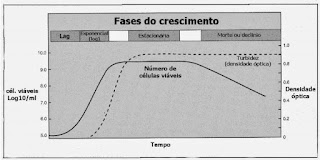
(1) FASE lag : A
primeira corresponde a fase lag, durante a qual ocorre intensa atividade
metabólica; contudo, as células não se dividem. Essa fase pode durar de alguns
minutos a muitas horas.
(2) FASE log (logarítmica) : Nesta
fase se observa rápida divisão celular. Fármacos β-lactâmicos, como as
penicilinas, atuam durante esta fase, uma vez que os fármacos são eficazes no
período em que as células estão produzindo peptidioglicano, isto é, quando
estão em divisão.
(3) FASE ESTACIONÁRIA : Ocorre
quando a depleção de nutrientes ou os produtos tóxicos provocam uma diminuição no
crescimento até que o número de células novas produzidas equilibra-se com o
número de de células que morrem, resultando em um steady state (estado de equilíbrio). As células cultivadas em um
aparato especial , denominado “quimiostato”, no qual nutrientes frescos são
adicionados e produtos de excreção são removidos continuamente, podem permanecer
na fase log e não entram em fase estacionária.
(4) FASE DE MORTE : Corresponde
à fase final, caracterizando-se por um declínio no número de células bacterianas
viáveis.
Figura 2 - Fases da curva de crescimento bacteriano
 |
| Fonte: http://slideplayer.com.br/slide/361163/ |
- MÉTODOS
PARA SE REALIZAR A CURVA DE CRESCIMENTO:
2.1 PRÁTICA 1 – Inoculação direta à partir de meio de enriquecimento.
- Em dois dias de aula prática.
- Em dois dias de aula prática.
ATENÇÃO: ESTE PRIMEIRO MÉTODO NÃO DEVE SER UTILIZADO PARA
PESQUISA. ELE FOI ELABORADO PELA PROFESSORA ZILKA NANES APENAS PARA ENTENDIMENTO DOS ALUNOS DE MICROBIOLOGIA BÁSICA SOBRE A CURVA DE CRESCIMENTO BACTERIANO. CASO
DESEJE UM MÉTODO REPRODUZÍVEL, UTILIZE O MÉTODO 2 - Verificação por turbidez no espectrofotômetro.
2.1.1 MATERIAL NECESSÁRIO:
•
Erlenmeyer de 250 mL * (para preparar o caldo BHI)
• Meio
de enriquecimento líquido* (BHI)
• 06 placas
de Petri (90x20 mm) com ágar BAB
• Palito
de dente ou swab*; ou alça bacteriológica
•
Solução fisiológica *
• Alça
de Drigalski (ou de vidro ou descartável)
• Tubos
de vidro com tampa baquelite*
•
Pipetas de vidro de 5 mL
• Escherichia coli em meio de cultura
sólido
•
Ponteiras amarelas* e pipetas analíticas
OBS: *
esse material deve ser estéril
2.1.2
PROCEDIMENTOS:
Inoculação direta à partir de meio de enriquecimento.
Inoculação direta à partir de meio de enriquecimento.
No
primeiro dia de aula prática:
No dia anterior - Preparar o meio BHI líquido
e o autoclavar. Colocar cerca de 5 mL do meio em um tubo de vidro. Com um
palito de dente, raspar um POUCO da cultura de E. coli na placa de Petri e encostar no meio de cultura (pré-inóculo).
Deixar crescer esse pré-inóculo de um dia para o outro à temperatura a ser testada,
sempre em agitação. (No primeiro dia de aula o caldo BHI já estará inoculado e incubado por
24 horas à 36ºC – pré-inóculo).
A) Para um novo tubo
com 5 mL de caldo BHI, transferir 10 µL do pré-inóculo. Marcar o
tempo inicial em um cronômetro. Homogeneizar
o caldo BHI, e com outra ponteira retirar 10 µL
e depositar na superfície do ágar BAB; flambar a alça de Drigalski e deixar
esfriar; posteriormente espalhar todo o inóculo com a alça de Drigalski até
este ser absorvido pelo meio. Marcar a placa como tempo ZERO, e incubá-la em
estufa bacteriológica à 36ºC. Incubar o caldo BHI em estufa bacteriológica até
completar 26 minutos.
B) Após este tempo,
preparar o material necessário para o próximo processamento (ágar BAB, alça de
Drigalski, pipetas analíticas e ponteiras). Quando completar 1 hora de
incubação pegar o caldo BHI e repetir o procedimento anterior [retirar 10 µL
e depositar na superfície do ágar BAB...], marcando agora esta placa como tempo
TRINTA MINUTOS, e incubá-la em estufa bacteriológica à 36ºC. Incubar o caldo BHI novamente em estufa bacteriológica
por mais tempo até completar 55 minutos.
C) Após este tempo,
preparar o material necessário para o próximo processamento (ágar BAB, alça de
Drigalski, pipetas analíticas e ponteiras). Quando completar 1 hora de
incubação pegar o caldo BHI e repetir o procedimento anterior [retirar 10 µL
e depositar na superfície do ágar BAB...], marcando agora esta placa como tempo
UMA HORA, e incubá-la em estufa bacteriológica à 36ºC. Incubar o caldo BHI novamente em estufa bacteriológica
até completar 85 minutos.
D) Após este tempo,
preparar o material necessário para o próximo processamento (ágar BAB, alça de
Drigalski, pipetas analíticas e ponteiras). Quando completar uma hora e meia de
incubação pegar o caldo BHI e repetir o procedimento anterior [retirar 10 µL
e depositar na superfície do ágar BAB...], marcando agora esta placa como tempo
UMA HORA E MEIA, e incubá-la em estufa bacteriológica à 36ºC. Incubar o caldo BHI novamente em estufa bacteriológica
por mais até completar 115 minutos.
E) Após este tempo,
preparar o material necessário para o próximo processamento (ágar BAB, alça de
Drigalski, pipetas analíticas e ponteiras). Quando completar duas horas de
incubação pegar o caldo BHI e repetir o procedimento anterior [retirar 10 µL
e depositar na superfície do ágar BAB...], marcando agora esta placa como tempo
DUAS HORAS, e incubá-la em estufa bacteriológica à 36ºC. Incubar o caldo BHI novamente em estufa bacteriológica
até completar 145 minutos.
F) Após este tempo,
preparar o material necessário para o próximo processamento (ágar BAB, alça de
Drigalski, pipetas analíticas e ponteiras). Quando completar duas horas e meia de
incubação pegar o caldo BHI e repetir o procedimento anterior [retirar 10 µL
e depositar na superfície do ágar BAB...], marcando agora esta placa como tempo
DUAS HORAS E MEIA, e incubá-la em estufa bacteriológica à 36ºC. Incubar o caldo BHI novamente em estufa bacteriológica
até completar 175 minutos.
Quando completar 3 horas de incubação, o número
de células de E.coli já estará acima
de 1000 colônias/mL. Recomenda-se então diluir 1:2 o caldo BHI antes de inocular
no ágar BAB, e depois usar fator de correção para calcular o número de
colônias.
No
segundo dia de aula prática:
-
Após incubar os meios de cultura (ágar BAB) por 24 horas à 36ºC, fazer a
contagem das colônias bacterianas, e interpretar os resultados.
Já que
10 µL corresponde a centésima parte do mL, o fator de correção para expressar o
número de colônias por mL, ou unidades formadoras de colônia (UFC); é 100, ou
seja, multiplica-se o número de colônias contadas por 100.
Exemplo:
45 colônias em 10 µL
45 x 100 = 4.500 UFC/mL ou colônias/mL
Tempo
|
Ágar BAB
(Número de colônias)
|
Unidades formadoras
de colônias por mL
|
ZERO
|
||
30 minutos
|
||
1 HORA
|
||
1:30
|
||
2 HORAS
|
||
2:30
|
||
TRÊS HORAS
|
TUTORIAL - CURVA DE CRESCIMENTO BACTERIANO
Bactéria: Escherichia coli ATCC 25922- Gravado em 16 de Setembro de 2016
Local: Laboratório de Atividade Antimicrobiana (UEPB- campus I)
Autora: Professora Zilka Nanes Lima
Clique no link para abrir o arquivo em pdf da tabela de conversão ufc g-1 - log10 ufc g-1 Tabela de conversão ufc g-1 - log10 ufc g-1
2.2
PRÁTICA 2 – Verificação por turbidez no espectrofotômetro. Em dois dias
de aula (No primeiro dia o caldo BHI já estará inoculado e incubado por 24
horas à 36oC – pré-inóculo) – O método que segue foi retirado de uma
apostila de curso de férias da UFRJ.
2.1.1.
MATERIAL NECESSÁRIO:
• Erlenmeyer de 250 mL *
• Palito de dente ou
swab*
• Solução fisiológica *
• Béquer *
• Tubos cônicos*
• Pipetas
• Escherichia coli
• Meio de enriquecimento
líquido* (BHI)
• Espectrofotômetro
OBS: * esse material
deve ser estéril
2.1.2.
PROCEDIMENTOS
Verificação por
turbidez no espectrofotômetro (figura 4)
Preparar
o meio BHI líquido e o autoclavar. Colocar cerca de 5 mL do meio em um tubo
cônico. Com um palito de dente, raspar um POUCO da cultura de E. coli na placa de Petri e encostar no
meio de cultura do tubo cônico (pré-inóculo). Trabalhar no fluxo laminar ou na
zona de segurança para evitar a contaminação por outros micro-organismos.
Deixar crescer esse pré-inóculo de um dia para o outro à temperatura a ser testada,
sempre em agitação. No dia seguinte, fazer uma diluição do pre-inóculo para
saber a concentração de bactérias no mesmo (exemplo 50 µL de pré-inóculo + 950
µL de solução fisiológica). Antes de ler a absorbância (ABS) à 600 nm do
pré-inóculo, fazer uma diluição do meio (50 µL de meio + 950 µL de água), ler
essa ABS e dar auto-zero para descontá-la. Posteriormente, ler a ABS da
diluição do pré-inóculo. Para começar o crescimento, o ideal é que ABS inicial
no meio de crescimento esteja aproximadamente 0,1 uma vez que o método
apresenta linearidade entre 0,1 e 0,4 de ABS. Logo, devo fazer o cálculo
mostrado no exemplo para saber a quantidade de pré-inóculo a ser colocada no
meio de crescimento.
Exemplo:
ABS da diluição do pré-inóculo = 0,073
Como
o pré-inóculo foi diluído 20 vezes (50µL/1000µL), então devo multiplicar por 20
a diluição do mesmo, logo ABS = 1,46 ABS/mL. Para começar o crescimento, quero
utilizar 30 mL de meio, logo a conta é a seguinte:
1,46. X = 0,1. 30
X = 2,06 mL de pré-inóculo
2,06
mL pré-inóculo + 27,94 mL meio = 30 mL total
Antes
de acrescentar o pré-inóculo no meio de crescimento, ler a ABS de 1 mL de meio
puro e dar auto-zero para descontar a cor do mesmo. Logo que o pré-inóculo for
acrescentado ao meio, verificar a ABS inicial, que corresponde ao tempo zero na
curva de crescimento. Colocar o Erlenmeyer à temperatura controlada e em
agitação contínua. Posteriormente, verificar a ABS de 30 em 30 minutos ou em
outros intervalos de tempo. A faixa de ABS em que o método é linear é de 0,1 a
0,4. Por esse motivo, em tempos tardios do crescimento deverá ser feita uma
diluição antes de ser verificada a ABS. Não se esqueça de multiplicar pelo
valor da diluição na hora de interpretar os dados! Não se esqueça de dar
auto-zero com o meio sem bactérias sempre antes de ler a alíquota em cada tempo
de crescimento!!! Construir um gráfico em que o eixo X é o tempo e o Y é cada ABS (figura 3).
Figura 3 - Crescimento Populacional de Bactérias.
Figura 3 - Crescimento Populacional de Bactérias.
 |
| Fonte: ebah |
Figura 4 - Turbidimetria (espectrofotômetro)
 |
| Fonte: Wiki AIA 13-17 |
Referências bibliográficas:
1.
Levinson, W. Microbiologia Médica e Imunologia. 13a
Edição. Ed. ArtMed. Porto Alegre – RS, 2016.
2.
http://ltc.nutes.ufrj.br/constructore/objetos/velocidade%20de%20divisao%20das%20bacterias.pdf
Acesso em 11 de Setembro de 2016.
3.
Conhecimento adquirido.
Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!