11. IDENTIFICAÇÃO DE COCOS GRAM-POSITIVOS
Como referenciar esta página: Nanes-Lima, Z.; Vieira, R.C.R., Silva, L.S. Identificação de cocos Gram-positivos. Detalhes Microbiológicos, Campina Grande, 09 nov. 2025. Disponível em: https://microimunoliga.blogspot.com/2016/09/11-identificacao-de-cocos-gram-positivos.html
(Microbiologia Básica / Profa . Zilka Nanes Lima)
Página atualizada em 09/11/2025
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.
IDENTIFICAÇÃO LABORATORIAL
(Staphylococcus spp e Streptococcus
spp.)
1 IDENTIFICAÇÃO PRELIMINAR: A identificação dos estreptococos e estafilococos é baseada na morfologia que apresentam em meios líquidos. Sendo o estreptococo uma cadeia normalmente
longa e os estafilococos mostrando-se em forma de cocos aos, em cachos e agrupados.
A identificação presuntiva começa com a inoculação primária na placa de ágar sangue de carneiro que deve ser incubada em 5% de tensão de CO2 (método da vela ou estufa de CO2). As colônias de estafilococos são
geralmente mairores, convexas, de coloração variando do branco-porcelana a amarelo podendo apresentar hemólise
ou não. Note-se que o desenvolvimento
da cor amarelada no Staphylococcus
aureus ocorre somente após incubação prolongada (72 h), á
temperatura ambiente. As colônias de estreptococos tendem a ser menores (puntiformes), e
com
halos de hemólise total (β=beta) ou parcial (α=alfa). A diferenciação entre os estreptococos e os estafilococos se dá, seguramente, pela prova da catalase.
Staphylococcus spp. são catalase positivos e Streptococcus
spp., que inclui Enterococcus spp, são
catalase negativos. Entre os cocos Gram-positivos isolados de amostras clínicas
também são catalase-positivos Micrococcus
spp., Planococcus spp., Stomatococcus spp. e Lactococcus spp.; e também são
catalase-negativos Aerococcus spp., Gemella spp., Leuconostoc spp. e Stomatococcus
spp.
Quadro 1) – Características
do crescimento
bacteriano
nos diversos
meios de cultura.
Bactéria
|
Tamanho
|
Borda ou
forma
|
Elevação
|
Densidade
|
Cor
|
Consis-
tência
|
Hemólise em
Agar Sangue
|
Crescimento em AMS
|
Odor
|
Staphylococcus aureus
|
Grande
|
Circular
|
Convexa
|
Opaca
|
Amarela ou
branca
|
Cremosa
|
Em geral
beta-
hemólise
|
Sim
|
Queijo
|
Staphylococcus
coagulase
negativo
|
Médio
|
Circular
|
Elevada
|
Opaca
|
Branca
|
Cremosa
|
Em geral
não
hemolítico
|
Sim
|
Queijo
|
Streptococcus do grupo viridans
|
Pequeno
|
Irregular
|
Achatada
|
Opaca
|
Branco-
acizentando
|
Brilhante
|
Alfa-hemólise
|
Não
|
|
S.agalactiae*
|
Médio
|
Circular
|
Convexa
|
Translúcida
|
Cinza
|
Cremosa
|
Beta-hemólise
|
Não
|
|
S.pyogenes*
|
Pequeno
|
Puntiforme
|
Convexa
|
Translúcida
|
Cinza
|
Brilhante
|
Beta-hemólise
|
Não
|
|
Enterococcus
faecalis
|
Médio
|
Circular
|
Elevada
|
Opaca
|
Cinza
|
Brilhante
|
Em geral
não
apresenta
hemólise
|
Sim
|
Caramelo
|
S.pneumoniae
|
Pequeno
|
Circular
|
Umbilicada
|
Opaca
|
Cinza
|
Brilhante
ou mucóide
|
Alfa-hemólise
|
Não
|
*a colônia pode ser removida completamente (inteira) do meio; AMS=Àgar Manitol Salgado (Fonte:Oplustil, 2010)
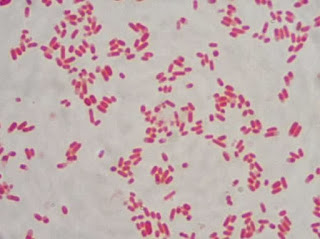
Figura 1 - Staphylococcus aureus e Staphylococcus epidermidis em ágar Sangue após 48 horas de incubação à 36ºC
 |
| Fonte: Nanes-Lima (Arquivo pessoal) |
2.TESTES DE IDENTIFICAÇÃO
(COCOS
GRAM-POSITIVOS)
A) GRAM (vide apostila sobre coloração de Gram)
2.1) TESTES
PARA IDENTIFICAÇÃO DE
Staphylococcus spp.:
B) CATALASE – Com a alça bacteriológica ou com um palito coleta-se o centro de uma colônia suspeita e esfrega-
se
em uma lâmina de vidro. Colocar
sobre este esfregação
uma gota de água oxigenada a 3% e observar a formação
de bolhas. O teste também pode ser realizado colocando-se cerca de 1 mL água oxigenada dentro de um tubo de hemólise posteriormente pega-se uma ou duas colônias suspeitas com alça bacteriológica mergulhando-se
então
dentro do líquido e observar a formação de bolhas. A formação de algumas pequenas bolhas depois de 20 a 30
segundos não é considerada um teste positivo.
Ainda existe outra possibilidade que é verter a água oxigenada por cima de uma cultura bacteriana
em meio que não contenha sangue. Para a família Micrococcaceae (estafilococos) a
prova é geralmente positiva, enquanto que para a
família Streptococcacea e (estreptococos) é
negativa.
PS:Ao coletar a colônia, não carregar meio de cultura (Agar sangue), que pode acarretar resultados falso-positivos porque o sangue do meio contém catalase. Algumas cepas de enterococos podem ter reação falsa positiva (fazer
Gram e ver disposição em cadeias curtas e aos pares).
C) PESQUISA DA PROTEÍNA A DE Staphylococcus spp. associada a pesquisa de coagulase: Este teste baseia-se na aglutinação simultânea da coagulase (clumping factor) e da proteína
A com as partículas de látex sensibilizadas com proteínas plasmáticas
antígeno específicas. Procedimento
técnico: 1.Em 3 espaços de uma placa
de fundo escuro adcionar respectivamente uma gota de controle positivo, uma gota de controle negativo e uma gota
de solução salina (homogeneizar previamente os controles); 2. Usando uma palito
de madeiras
ou plástico,
emulsionar na gota de salina 2 a colônias suspeitas em análise; 3. Homogeneizar o látex e adicionar uma gota em
cada
círculo; 4. Usando palitos de madeira diferentes, homogeneizar o conteúdo de cada círculo; 5. Agitar a placa
em movimentos rotatórios (manuais ou agitador de Kline regulado para 110-120 rpm); 6. Sob uma boa fonte de luz branca incidente ler os resultados segundo a descrição que segue – #TESTE NEGATIVO:
Suspensão homogênea(opaca), ausência de aglutinação. / #TESTE DUVIDOSO: Suspensão opaca contendo alguns grumos em quantidade de pouco a moderada, pode-se tratar de cepas que apresentem apenas a proteína
A ou
o apenas o fator
clumping, teste duvidoso. # TESTE POSITIVO: Suspensão límpida com grumos grandes e
bem
visíveis.
*Interpretação: Colônias estafilocócicas contendo
o
fator
“clumping” e/ou
proteína A,
quando misturadas
as partículas de látex, produzem aglutinação visível a olho nu geralmente dentro de 45 segundos. Algumas cepas de S. aureus meticilina resistentes podem dar aglutinações
fracas, nestes casos e nos demais aonde possa existir dúvida,
recomenda-se submeter a cepa á prova da DNAse para confirmação.
D) COAGULASE
D.1) TESTE DO FATOR “CLUMPING” OU COAGULASE LIGADA (EM LÂMINA): A maioria das cepas de Staphylococcus aureus possuem a coagulase ligada (ou fator aglutinante) “clumping factor” na superfície da parede celular, que reage com o fibrinogênio do plasma causando a coagulação do mesmo. * Colocar 2 gotas de salina ou de água destilada em dois pontos de uma mesma lâmina, emulsifique delicadamente o material da colônia de Staphylococcus spp. a ser testada em ambos deixar coalescer; * Colocar uma gota de plasma em um dos círculos, no outro(que é o controle) colocar uma gota de salina ou água destilada e misturar com um palito de plástico ou madeira; * Observar se há aglutinação no círculo teste em 10 segundos; * Não se pode executar este teste a partir de uma ágar com grande concentração de sal como o Ágar Manitol Salgado.
D.2) TESTE DA COAGULASE EM TUBO: Teste baseado na presença da coagulase livre que reage com um fator plasmático formando um complexo que atua sobre o fibrinogênio formando a fibrina. O teste é melhor efetuado se: * Adicionar 0,1 mL de caldo BHI, incubado por uma noite, com colônia suspeita a um tubo de ensaio com 0,5 mL de plasma; (Um método alternativo pode ser realizado inoculando-se umas 2 colônias com alça bacteriológica em 0,5 mL de plasma); *Incubar por 4 horas á 35oC em estufa ou banho maria;*Faz-se a leitura com 1, 2, 3 e 4 horas sempre retornando o tubo à incubação caso o teste esteja negativo; * A formação de um coágulo é observada pela inclinação suave do tubo de ensaio a 90 graus da vertical. (Qualquer coágulo indica uma prova positiva, porém não confundir com precipitados ou floculação. O melhor plasma a ser usado é o de coelho com EDTA, não devendo ser usado o plasma humano vindo de banco de sangue). Se não for observado coágulo nessa ocasião, incube novamente o tubo à temperatura ambiente e faça a leitura novamente após 18 horas. As fibrinolisinas produzidas pelo microrganismo também podem dissolver o coágulo logo após sua formação.
E) DNAse: Este teste consiste na inoculação de colônias do microrganismo em meio contendo DNA (DNAse test Ágar).O meio pode ser utilizado para teste com ou sem corante. Quando prepara-se o meio com corante utiliza- se azul de ortoluidina na concentração de 0,1%, assim o meio adquire uma coloração azul intensa. Para inocular este meio faz-se um círculo com a massa bacteriana com auxílio de alça bacteriológica ou palito: *Incuba-se então a 35oC por 2 horas; *Interpretação do meio de DNAse sem corante: *Abrir a placa em cima de uma superfície escura e verter HCl 1 N permitindo cobrir todo o meio, esperar 1 minuto para que haja precipitação do DNA que resta no meio; a presença de um halo claro ao redor do inoculo indica um teste positivo. *Interpretação do meio de DNAse COM azul de ortotoluidina: Uma coloração rósea característica ao redor das colônias produtoras de DNAse indica a positividade da prova.
D) COAGULASE
D.1) TESTE DO FATOR “CLUMPING” OU COAGULASE LIGADA (EM LÂMINA): A maioria das cepas de Staphylococcus aureus possuem a coagulase ligada (ou fator aglutinante) “clumping factor” na superfície da parede celular, que reage com o fibrinogênio do plasma causando a coagulação do mesmo. * Colocar 2 gotas de salina ou de água destilada em dois pontos de uma mesma lâmina, emulsifique delicadamente o material da colônia de Staphylococcus spp. a ser testada em ambos deixar coalescer; * Colocar uma gota de plasma em um dos círculos, no outro(que é o controle) colocar uma gota de salina ou água destilada e misturar com um palito de plástico ou madeira; * Observar se há aglutinação no círculo teste em 10 segundos; * Não se pode executar este teste a partir de uma ágar com grande concentração de sal como o Ágar Manitol Salgado.
D.2) TESTE DA COAGULASE EM TUBO: Teste baseado na presença da coagulase livre que reage com um fator plasmático formando um complexo que atua sobre o fibrinogênio formando a fibrina. O teste é melhor efetuado se: * Adicionar 0,1 mL de caldo BHI, incubado por uma noite, com colônia suspeita a um tubo de ensaio com 0,5 mL de plasma; (Um método alternativo pode ser realizado inoculando-se umas 2 colônias com alça bacteriológica em 0,5 mL de plasma); *Incubar por 4 horas á 35oC em estufa ou banho maria;*Faz-se a leitura com 1, 2, 3 e 4 horas sempre retornando o tubo à incubação caso o teste esteja negativo; * A formação de um coágulo é observada pela inclinação suave do tubo de ensaio a 90 graus da vertical. (Qualquer coágulo indica uma prova positiva, porém não confundir com precipitados ou floculação. O melhor plasma a ser usado é o de coelho com EDTA, não devendo ser usado o plasma humano vindo de banco de sangue). Se não for observado coágulo nessa ocasião, incube novamente o tubo à temperatura ambiente e faça a leitura novamente após 18 horas. As fibrinolisinas produzidas pelo microrganismo também podem dissolver o coágulo logo após sua formação.
E) DNAse: Este teste consiste na inoculação de colônias do microrganismo em meio contendo DNA (DNAse test Ágar).O meio pode ser utilizado para teste com ou sem corante. Quando prepara-se o meio com corante utiliza- se azul de ortoluidina na concentração de 0,1%, assim o meio adquire uma coloração azul intensa. Para inocular este meio faz-se um círculo com a massa bacteriana com auxílio de alça bacteriológica ou palito: *Incuba-se então a 35oC por 2 horas; *Interpretação do meio de DNAse sem corante: *Abrir a placa em cima de uma superfície escura e verter HCl 1 N permitindo cobrir todo o meio, esperar 1 minuto para que haja precipitação do DNA que resta no meio; a presença de um halo claro ao redor do inoculo indica um teste positivo. *Interpretação do meio de DNAse COM azul de ortotoluidina: Uma coloração rósea característica ao redor das colônias produtoras de DNAse indica a positividade da prova.
F) TESTE DA RESISTÊNCIA À NOVOBIOCINA: A cepa é semeada de maneira semelhante ao antibiograma em placa de Ágar
Müeller Hinton acrescida de um disco de novobiocina contendo 5 µg. As amostras
resistentes mostram zonas de inibição de 6 a 12 mm, enquanto as susceptíveis
apresentam halos de 16 mm ou mais. As cepas de Staphylococcus saprophyticus apresentam resistência intríseca a
novobiocina.
A
diferenciação de Staphylococcus spp.
de Micrococcus spp. se dá pela
coloração de Gram, em que os Micrococcus aparecem
em tétrades, ou pela pigmentação de suas colônias (amarelas, róseas ou
alaranjadas). Alguns não apresentam pigmentos e podem ser diferenciados pela
sensibilidade a Bacitracina 0,004 unidades/disco, a mesma utlizada na
identificação de Streptococcus pyogenes,
mas utilizando-se a inoculação em ágar Müeller Hinton.
Quadro
2.a.) Identificação das
espécies de Staphylococcus spp. de maior importância clínica. --- Nível de complexidade 1
Espécie
|
Hemólise
|
Proteína A
|
Coagulase
|
DNAse
|
Novobiocina
|
S. aureus
|
+
|
+
|
+
|
+
|
S
|
S.epidermidis
|
neg
|
neg
|
neg
|
neg
|
S
|
S. saprophyticus
|
neg
|
neg
|
neg
|
neg
|
R
|
(S.)= Staphylococcus
/ + = teste positivo / neg = teste negativo / S = sensível / R
= resistente
(Fontes:
Koneman
et al., 2008/ Detecção e Identificação de
bactérias
de importância médica. Vol.6, 2014 – ANVISA)
Quadro
2.b)
Identificação das
espécies de Staphylococcus spp. de maior importância clínica. ---- Nível de complexidade 2
Espécie
|
DNAse
|
PYR
|
NOV
|
Urease
|
POL
|
Outras
|
S. aureus
|
(+)
|
Neg
|
S
|
V
|
R
|
Pigmento
amarelo
|
S.epidermidis
|
Neg
|
Neg
|
S
|
(+)
|
R
|
Trealose negativa
|
S. lugdunensis
|
Neg
|
(+)
|
S
|
V
|
S
|
Ornitina (+)
|
S. haemolyticus
|
Neg
|
(+)
|
S
|
Neg
|
S
|
Ornitina(-)
Trelose positiva
|
S.saprophyticus
|
Neg
|
Neg
|
R
|
(+)
|
S
|
Isolado
de urina
Trealose positiva
|
S. schleiferi
|
Neg
|
(+)
|
S
|
Neg
|
S
|
Sacarose
negativa
|
S. intermedius
|
(+)
|
(+)
|
S
|
Neg
|
S
|
|
S.hycus
|
(+)
|
Neg
|
S
|
V
|
R
|
|
S. hominis
|
Neg
|
Neg
|
S
|
(+)
|
V
|
|
S.capitis
|
Neg
|
Neg
|
S
|
Neg
|
S
|
|
S.cohnii
|
Neg
|
Neg
|
S
|
Neg
|
S
|
(S.)=Staphylococcus
/ + = teste positivo / neg = teste negativo / S = sensível / R = resistente
(Fontes:
Koneman
et al., 2008/ Detecção e Identificação de
bactérias
de importância médica. Vol.6, 2014 – ANVISA)
2.2) TESTES PARA IDENTIFICAÇÃO DE Streptococcus spp. e Enterococcus spp.:
Os estreptococos podem ser diferenciados de acordo com sua aparecência na placa de Ágar sangue após incubação a 35oC em presença de 5% de CO2, podendo apresentar: hemólise total (β=beta, halo transparente ao redor do crescimento bacteriano), parcial (α=alfa, de cor esverdeada) ou nenhuma (γ=gama).
A identificação de espécies de Streptococcus beta-hemolíticos é feita através de aglutinação com soros
específicos contra os antígenos de Lancefield (A,B,C,,D,F e G), que constitui uma prova rápida, porém não acessível a
todos os laboratórios em virtude do custo elevado.
G) DETERMINAÇÃO DO GRUPO SOROLÓGICO DE LANCEFIELD POR AGLUTINAÇÃO (Streptococcus β-hemolíticos): (Teste retirado do procedimento técnico da
Phadebact ®.
Declaro que não tenho conflito de interesses).
O kit
é baseado na técnica de coaglutinação que permite identificação definitiva dos
grupos de estreptococos A, B, C, D, F e G usando uma técnica simples e rápida.
G.1) Procedimentos:
G.1.1 Teste direto de colônias: Verifique na placa de cultura primária a
presença de colônias beta-hemolíticas. Remova 1-5 colônias de estreptococo
beta-hemolítico com uma alça de inoculação ou equivalente, em um número
suficiente para espalhar em 2-6 círculos selecionados no cartão de teste. Estas
colônias são usadas no teste.
G.1.2. Extração direta de colônia (opcional): O procedimento de extração
direta usando a “Phadebact Solução de Extração” - distribuído pela Bactus AB –
pode ser considerado para aquelas situações em que: • Material insuficiente de
amostra está presente na colônia que o teste requer (1-5 colônias por
reagente); • Resultados inconclusivos são obtidos com teste direto da colônia. Atenção!
Strep D e Strep F não são indicados para extração (recomenda-se meio de
inoculação).
G.1.3. Meio de inoculação: Verifique na placa de crescimento a presença
de colônias beta-hemolíticas. Remova 1 ou mais colônias de estreptococo
beta-hemolítico. Inocule dentro de 2 ml de meio de crescimento. Incube de
35-37ºC por uma noite ou até a turbidez ser evidente (equivalente ao padrão de
turbidez 2-3 na escala Mac-Farland). Usualmente crescimento suficiente ocorre
após 4 horas de incubação, usando 0,5 ml de meio e diversas colônias. Gotas
desta suspensão são usadas para o teste.
G.2)
Interpretação:
• Resultados positivos:
Uma reação significantemente forte e rápida de aglutinação é visível nos
reagentes testados.
• Resultados negativos:
Nenhuma reação em qualquer dos reagentes é visível, isto indica que a bactéria
testada não pertence ao grupo A, B, C, D, F ou G ou que a amostra não contém
material antigênico suficiente. Veja as LIMITAÇÕES DE PROCEDIMENTO mais abaixo.
• Resultados não
interpretáveis: Se ocorrer coaglutinação de igual intensidade forte e
velocidade com mais de um reagente verifique as LIMITAÇÕES DE PROCEDIMENTO.
H) TESTE DA BACITRACINA E DO SULFAMETOXAZOL: É importante notar que as identificações devem ser feitas em Agar sangue SEM TENSÃO de CO2 ou os resultados podem ser conflitantes. * Pegue 3 a 4 colônias
isoladas do estreptococo beta-hemolítico e espalhe o inóculo no centro da metade de uma placa de Agar sangue; *
Usando alça bacteriológica ou swab esterilizados, espalhe o inóculo como
uma
camada sobre toda a metade da placa
de Agar sangue; *Coloque de maneira asséptica um disco de bacitracina 0,004 Unidades/disco e um disco SXT (Sulfametoxazol+trimetropim, 23,75 µg / 1,25 µg.), um ao lado do outro. Certifique-se de que os discos estão
separados a uma distãncia uniforme. Usando pinças flambadas, comprima delicadamente os discos para eles aderirem á superfície do ágar. * Incube a placa ao ar ambiente a 35oC. ## Interpretação: Sensível(S): Qualquer zona
em
torno de qualquer dos discos / Resistente(R): Crescimento por sobre a borda do disco.
Bacitrancina
|
SXT
|
IDENTIFICAÇÃO
|
S
|
R
|
Grupo A presuntivo
|
R
|
R
|
Grupo B presuntivo
|
S/R
|
S
|
Não são
dos grupos A ou B
|
S= sensível / R=resistente /
SXT=sulfametoxazol+trimetoprim
Havendo necessidade, pode ser feito o teste de CAMP na mesma placa dos testes de bacitracina e SXT
I) TESTE DE CAMP (na mesma placa de BAC
e SXT): * Inocular uma estria única de uma amostra de Staphylococcus aureus produtor de beta lisina (ATCC 25923) no centro de uma placa de Agar sangue preparada obrigatoriamente com
sangue de carneiro. (Esta linhagem de S.aureus deve ser mantida continuadamente
em estoque). * Inocular as amostras a serem
testadas em estrias formando um ângulo reto com a linha de inoculação da amostra teste de estafilococo. As estrias não devem se tocar, ficando a 1 mm de distância, e deste modo várias amostras podem ser
testadas em uma mesma placa de Agar sangue. A maneira de inocular é fundamental para observação do efeito
esperado. *
Incubar a placa a 35-37oC durante um período de18-24 horas;
* A
positividade da prova, Streptococcus
agalactiae (grupo B), é evidenciada
pelo
alargamento da zona de lise, que adquire a forma de ponta de flecha
característica, na área de intersecção entre as duas estrias.
Para
fazer somente o teste de Camp (sem outros testes juntos): 1. Com auxílio do fio
bacteriológico, semear na superfície de meio Ágar Sangue a cepa de Staphylococcus aureus ATCC 25923 com uma
única linha reta; 2. Novamente com o fio bacteriológico (flambado), tocar nas
colônias em estudo; e semear uma única linha reta na superfície do meio Ágar
Sangue, perpendicularmente à linha de semeadura do S. aureus, sem tocar no inóculo do S. aureus; 3. Logo em seguida, sem flambar o fio, picar o meio Ágar
Sangue duas vezes, uma de cada lado da semeadura da cepa em estudo, sem tocar
nas duas linhas de inóculo já feitos (a do S.
aureus e da cepa em estudo);4. Incubar à 35ºC 24 horas. 5. Interpretação: *
Positivo: Aumento da área de hemólise em forma de flecha no local onde estão
mais próximas as duas estrias de crescimento. / *Negativo: Ausência de aumento
da hemólise. Observa-se nitidamente a hemólise do S. aureus e da cepa em
estudo, inalteradas.
# O teste de CAMP usa-se de uma relação entre o Streptococcus a ser testado e o Staphylococcus. A
proteína produzida pelo S.agalactiae sensibiliza hemácias mas não as hemolisa. Esse comportamento
é chamado de hemolisina incompleta. O teste CAMP usa
então essa característica dos Streptococcus e faz uma ação
sinérgica entre ele
e a beta lisina, produzida pelo S.
aureus para que assim ocorra hemólise do tipo beta (total).
J) TESTE ou REAÇÃO DO PYR: Este teste determina a atividade
do PYR também chamado pyrrolidonyl-
aminopeptidase, uma enzima produzida
pelo
Streptococcus pyogenes e também pelo Enterococcus spp, esta enzima confere hidrólise da L-pyrrolidonyl-beta-naphytylamide. Utilizar
somente colônias puras para o teste, pois podem
surgir resultados errôneos. * Com o auxílio de uma pinça previamente flambada, retirar um disco de PYR do frasco.
*Utilizando uma pipeta ou um frasco conta-gotas, impregnar
o disco de PYR com água destilada estéril ou água de
torneira (o uso de salina torna a reação mais lenta e menos intensa); *Depositá-la sobre uma lâmina ou placa de
Petri; *Com um auxílio de uma alça previamente flambada, faça um esfregaço da bactéria recém
isolada a ser
identificada no disco de PYR umedecido. * Aguardar 5 minutos, a temperatura ambiente, e colocar uma gota do revelador de cor (p-dimetilaminocinamaldeído). Havendo beta-naphytilamide livre, esta forma uma base de Schiff
que forma um precipitado fúcsia As reações positivas ocorrem em até 1 minuto. ## Leitura: PYR POSITIVO: O
desenvolvimento de uma cor vermelho-cereja indica resultado positivo. / PYR NEGATIVO:Uma coloração amarela ou alaranjada indica resultado negativo.
L) TESTE DE BILE ESCULINA: * Com uma agulha ou alça de inoculação, toque em duas ou três colônias de estreptococos morfologicamente
semelhantes e inocule o Agar inclinado do meio de bile-esculina com um
movimento em S, ou faça estrias na superfície de uma placa de bile-esculina para isolamento. * Incube o tubo
ou placa a 35oC por 24-48 horas numa estufa ao ar ambiente. ##Interpretação: O escurecimento difuso de mais da
metade da inclinação do Agar no intervalo de 24-48 horas indica hidrólise da esculina. Nas placas, halos negros vão ser observados em torno de colônias isoladas, e qualquer escurecimento é considerado positivo. (Todos os
etreptococos do grupo D são positivos para bile-esculina em 48 horas.
M) TESTE DE TOLERÂNCIA AO SAL (BHI + NaCl 6,5%): *Inocule 2 ou 3 colônias no meio líquido; *Incube por uma noite a 35oC numa estufa ao ar ambiente. ## Interpretação: Um teste positivo consiste na presença de crescimento bacteriano óbvio no meio. Se o estreptococo for positivo para bile-esculina e crescer em meio líquido de NaCl a 6,5% estamos diante da espécie Enterococcus spp. Se for positivo para bile-esculina e não crescer em meio líquido contendo NaCl a 6,5% é um estreptococo do grupo D não enterococo.
N) TESTE DA OPTOQUINA: *Usando uma alça bacteriológica, escolha 3 a 4 colônias bem isoladas do micro-organismo a ser testado e espalhe o inóculo no centro da metade de uma placa de Agar sangue; a área inoculada deve ter cerca de 3 cm2. * Coloque um disco de optoquina no terço superior da área em que foram espalhadas as colônias. Comprima o disco com uma pinça flambada, de modo que o disco possa aderir firmemente à superfície do ágar. *Incube a placa a 35oC por 18 a 24 horas num jarro com vela ou em atmosfera de CO2 a 5-7% (denominado microaerofilia). ## Interpretação: Uma zona de inibição de 14 mm ou mais a volta de um disco de 6 mm significa sensibilidade e identifica Streptococcus pneumoniae. Streptococcus do grupo viridans podem ser identificado presuntivamente como S. pneumoniae caso apresente uma zona de inibição de 14 mm ou mais em torno de um disco de 6 mm (monodisco contendo 5µg optquina). Os micro-organismos que apresentam zonas menores que essas devem ser testados quanto à solubilidade em bile.
A optoquina hidrossolúvel e se difunde prontamente em meios de ágar. Por essa razão, podem ser utilizados discos de papel de filtro impregnados com optoquina em formato de teste de difusão em disco para se determinar a suscetibilidade de pneumococos suspeitos e confirmar-se desde modo, sua identidade como tal. As células de S. pneumoniae sofrem lise, devido a alterações ,e é produzida uma zona de inibição.
M) TESTE DE TOLERÂNCIA AO SAL (BHI + NaCl 6,5%): *Inocule 2 ou 3 colônias no meio líquido; *Incube por uma noite a 35oC numa estufa ao ar ambiente. ## Interpretação: Um teste positivo consiste na presença de crescimento bacteriano óbvio no meio. Se o estreptococo for positivo para bile-esculina e crescer em meio líquido de NaCl a 6,5% estamos diante da espécie Enterococcus spp. Se for positivo para bile-esculina e não crescer em meio líquido contendo NaCl a 6,5% é um estreptococo do grupo D não enterococo.
N) TESTE DA OPTOQUINA: *Usando uma alça bacteriológica, escolha 3 a 4 colônias bem isoladas do micro-organismo a ser testado e espalhe o inóculo no centro da metade de uma placa de Agar sangue; a área inoculada deve ter cerca de 3 cm2. * Coloque um disco de optoquina no terço superior da área em que foram espalhadas as colônias. Comprima o disco com uma pinça flambada, de modo que o disco possa aderir firmemente à superfície do ágar. *Incube a placa a 35oC por 18 a 24 horas num jarro com vela ou em atmosfera de CO2 a 5-7% (denominado microaerofilia). ## Interpretação: Uma zona de inibição de 14 mm ou mais a volta de um disco de 6 mm significa sensibilidade e identifica Streptococcus pneumoniae. Streptococcus do grupo viridans podem ser identificado presuntivamente como S. pneumoniae caso apresente uma zona de inibição de 14 mm ou mais em torno de um disco de 6 mm (monodisco contendo 5µg optquina). Os micro-organismos que apresentam zonas menores que essas devem ser testados quanto à solubilidade em bile.
A optoquina hidrossolúvel e se difunde prontamente em meios de ágar. Por essa razão, podem ser utilizados discos de papel de filtro impregnados com optoquina em formato de teste de difusão em disco para se determinar a suscetibilidade de pneumococos suspeitos e confirmar-se desde modo, sua identidade como tal. As células de S. pneumoniae sofrem lise, devido a alterações ,e é produzida uma zona de inibição.
O hidrocloreto de etil-hidrocupreína (Optoquina), um derivado do quinino, inibe seletivamente o crescimento de Streptococcus pneumoniae em concentrações muito baixas (5µg/mL ou menos). A optoquina também pode inibir outros estreptococos, mas somente em altas concentrações.
Quadro 3.
Identificação das
espécies de Streptococcus spp.
de maior importância clínica
Micro-organismo
|
Hemólise
|
Bacitracina
|
Sulfametoxazol+
trimetropim
|
CAMP
teste
|
PYR
|
Bile
Esc.
|
NaCl
6,5%
|
Optoquina
|
Grupo A
|
beta
|
S
|
R
|
(-)
|
+
|
(-)
|
(-)
|
R
|
Grupo
B
|
beta,
nenhuma
|
R
|
R
|
+
|
(-)
|
(-)
|
V
|
R
|
Grupos
C,F,G
|
beta
|
V
|
S
|
(-)
|
(-)
|
(-)
|
(-)
|
R
|
Grupo
D
Enterococo
|
alfa, beta,
nenhuma
|
R
|
R
|
(-)
|
+
|
+
|
+
|
R
|
Grupo
D
Não enterococo
|
Alfa,
nenhuma
|
R
|
S
|
(-)
|
(-)
|
+
|
(-)
|
R
|
Strep.viridans
|
Alfa,
nenhuma
|
V
|
S
|
(-)
|
(-)
|
V
|
(-)
|
R
|
Strep.pneumoniae
|
Alfa
|
V
|
S
|
(-)
|
(-)
|
(-)
|
(-)
|
S
|
S=sensível
/ R=resistente / (+)=positivo / (-)=negativo / V=variável
(Fontes:
Koneman
et al., 2008/ Detecção e Identificação de
bactérias
de importância médica. Vol.6, 2014 – ANVISA)
O) SOROLOGIA POR AGLUTINAÇÃO (Streptococcus pneumoniae): (Teste retirado do procedimento técnico da Phadebact ®. Declaro que não tenho conflito de interesses).
O.1) Procedimentos:
• Utilizando uma alça de inoculação, coletar colônias da placa de cultura;
• Espalhar as colônias por completo do poço pré-determinado do cartão teste;
• Adicionar uma gota do reagente de teste e uma gota de reagente controle no poço marcado;
• Agitar o cartão de teste manualmente;
• Leitura do resultado dentro de 1 minuto.
• Utilizando uma alça de inoculação, coletar colônias da placa de cultura;
• Espalhar as colônias por completo do poço pré-determinado do cartão teste;
• Adicionar uma gota do reagente de teste e uma gota de reagente controle no poço marcado;
• Agitar o cartão de teste manualmente;
• Leitura do resultado dentro de 1 minuto.
O.2) Interpretação:
• Resultado positivo: ocorre uma reação significantemente forte com o reagente Streptococcus pneumoniae comparado ao reagente de controle.
• Resultado negativo: Falta de reação no reagente Streptococcus pneumoniae com reação negativa (fraca ou nenhuma reação) no reagente de controle.
Referências bibliográficas:
- Módulo 6 (Detecção e Identificação de Bactérias de Importãncia
Médica) - Manuais de Microbiologia Clínica para o Controle de Infecção em Serviços de Saúde – ANVISA
(Agência
Nacional de Vigilância Sanitária). Disponível para impressão gratuita (9 módulos): Acesso em 13 de Setembro de 2016 PS: Não consegui deixar o link da referência mais recente, estou deixando o link da edição anterior. . www.anvisa.gov.br/servicosaude/microbiologia/mod_5_2004.pdf
- Koneman et al. Diagnóstico Microbiológico. Texto e Atlas Colorido : São Paulo, SP. Panamericana, 2008.
- Oplustil, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Procedimentos Básicos em Microbiologia
Clínica, 3ª Edição. Ed. Sarvier, São Paulo, SP, 2010.
- Santos, F. L. Manual de Microbiologia Clínica. 3ª Edição, Ed. Universitária, João
Pessoa, PB, 2003.
- Levinson, W. Microbiologia
Médica e Imunologia. 13a Edição. Ed. ArtMed. Porto Alegre – RS,
2012.
- Trabulsi, L.R. Microbiologia, 5aEdição.Ed. Atheneu,
São Paulo, SP. 2008.
- Procedimento técnico Phadebact ® de coaglutinação para a identificação dos grupos de estreptococos A,
B, C, D, F e G. http://www.alka.com.br/site/produto-detalhe.asp?cod=1433 Acesso em 13 de Setembro de 2016.
- Procedimento técnico Phadebact ® PNEUMOCOCCUS para identificação de Streptococcus pneumoniae. http://www.alka.com.br/site/ Acesso em 19 de Setembro de 2016.
- Procedimento técnico Phadebact ® PNEUMOCOCCUS para identificação de Streptococcus pneumoniae. http://www.alka.com.br/site/ Acesso em 19 de Setembro de 2016.
- Conhecimento adquirido.
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.
É permitido compartilhar o conteúdo com crédito às autoras, sem uso comercial e sem modificações.


Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!