8. ZIEHL NEELSEN
Como referenciar esta página: Nanes-Lima, Z.; Vieira, R.C.R., Silva, L.S. Ziehl Neelsen. Detalhes Microbiológicos, Campina Grande, 10 nov. 2025. Disponível em: https://microimunoliga.blogspot.com/2016/08/pratica-8.html  |
| Paul Ehrlich: desenvolveu a coloração ácido-resistente ou coloração de Ehrlich em 1882 para a identificação do bacilo da tuberculose, o Mycobacterium tuberculosis. Fonte: pt.m.wikipedia.org/ |
(Microbiologia Básica / Profa . Zilka Nanes Lima)
 A amostra
de maior
rendimento
para o diagnóstico da
TB pulmonar é o escarro proveniente da árvore brônquica, obtido após o esforço da tosse. Algumas particularidades devem ser consideradas
pelos
profissionais
de saúde,
por exemplo, recomenda -se
a ingestão de pelo menos 2 litros de água no dia anterior, com a finalidade de mobilizar a secreção pulmonar. (Campinas et.al, 2002)
A amostra
de maior
rendimento
para o diagnóstico da
TB pulmonar é o escarro proveniente da árvore brônquica, obtido após o esforço da tosse. Algumas particularidades devem ser consideradas
pelos
profissionais
de saúde,
por exemplo, recomenda -se
a ingestão de pelo menos 2 litros de água no dia anterior, com a finalidade de mobilizar a secreção pulmonar. (Campinas et.al, 2002) Coletar
em frasco
estéril de boca larga,
pref erencialmente três amostras em
dias consecutivos ou alternados, do primeiro escarro da manhã após higiene bucal prévia.
Coletar
em frasco
estéril de boca larga,
pref erencialmente três amostras em
dias consecutivos ou alternados, do primeiro escarro da manhã após higiene bucal prévia.

 Encaminhar ao laboratório à a temperatura ambiente (20 a 25oC) até 2 horas após a coleta, ou até 48 horas se mantida sob refrigeração (2 a 8oC).
Encaminhar ao laboratório à a temperatura ambiente (20 a 25oC) até 2 horas após a coleta, ou até 48 horas se mantida sob refrigeração (2 a 8oC).
 Coletar em frasco estéril três amostras
colhidas em dias consecutivos
ou alternados de todo o volume da primeira urina da manhã,
desprezando o primeiro jato, após higiene genital prévia.
Coletar em frasco estéril três amostras
colhidas em dias consecutivos
ou alternados de todo o volume da primeira urina da manhã,
desprezando o primeiro jato, após higiene genital prévia.
 Manter a amostra refrigerada (2 a 8oC) até encaminhar ao laboratório no prazo máximo de
Manter a amostra refrigerada (2 a 8oC) até encaminhar ao laboratório no prazo máximo de NÃO É INDICADA A REALIZAÇÃO DO
EXAME
EM AMOSTRAS
DE URINA COLETADAS DURANTE 24 HORAS
NÃO É INDICADA A REALIZAÇÃO DO
EXAME
EM AMOSTRAS
DE URINA COLETADAS DURANTE 24 HORAS
Página atualizada em 09/11/2025
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.
Coloração de Ziehl-Neelsen
(Pesquisa de BAAR)
I).Príncipio:
A coloração para
bacilos álcool-ácido resistentes (BAAR) é utilizada basicamente para micobactérias, sendo esta coloração o método mais rápido para a detecção de BAAR em amostras clínicas (Oplustil et. al., 2010).
Baseia-se no fato
da capacidade de álcool -ácido-resistência apresentada por deterteminadas bactérias (Mycobacterium tuberculosis e Mycobacterium leprae), quando tratadas
com uma solução de Fucsina fenicada à quente. Tais bactérias resistem ao tratamento posterior com um ácido forte, mantendo-se com a coloração inicial vermelha, enquanto outras descoram e apresentam a coloração de fundo, que é geralmente obtida com azul de metileno.
II).
Sinonímia: Coloração de
BAAR,
Pesquisa de
B.K. (Bacilo
de Koch), Baciloscopia, Pesquisa
de micobactéria, Pesquisa de B.H., M.L. ou M.H. (Bacilo de Hansen, Mycobacterium leprae ou hanseni).
III).Material clínico:
Amostras de escarro:
Amostras de urina:
24 horas.
PS: Outras tipos de amostras também podem ser utilizadas. Aqui estão representadas as mais frequentes.
IV).Procedimento:
A) Preparo do esfregaço
Amostras de escarro
# Selecionar a parte mais purulenta e espalhar em ¾ da lâmina. Após tratamento (com soluções diluídas de ácido – HCl 1N - ou base – NaOH 4%) e concentração da amostra preparar outra lâmina com o sedimento.
#Deixar secar dentro da cabine de segurança e fixar no calor antes de corar.
Amostras de urina
# Centrifugar
todo o volume da amostra em centrífuga refrigerada 5.000 rpm (3.000xg)
por 15 minutos
# Desprezar o sobrenadante, homogeneizar o sedimento e com uma alça bacteriológica depositar uma gota
do
sendimento em uma lâmina.
#Deixar secar dentro da cabine de segurança e fixar
no
calor antes de corar.
B) Coloração
1. Fixar o esfregaço no calor
2.
Cobrir o esfregaço com fucsina de Ziehl
3. Aquecer a parte inferior da lâmina com a chama do bico de Bunsen até observar a emissão de vapores e deixar 5 minutos
4. Lavar com água corrente
5.
Cobrir o esfregaço com álcool-ácido e deixar por 1 minuto
6.
Lavar com água corrente
7. Cobrir o esfregaço com azul de metileno e deixar por 2 minutos
8.
Lavar com água corrente
9.
Deixar secar ao ar.
Figura 1 - Esquema com os passos da Coloração de Ziehl Neelsen.
V). Leitura ao microscópio:
Observar em objetiva de de imersão (100x). A leitura deve ser conduzida de uma forma sistemática e padronizada, considerando-se dois aspectos distintos. O primei ro compreende a contagem de germes em cada campo miscroscópico, que é dividido mentalmente em quatro quadrantes, iniciando-se no
quadrante superior direito. O segundo refere-se ao
número de
campos
miscroscópicos observados,
devendo
ser observado um total de cem campos miscroscópicos seqüenciados em
linha reta, a partir do local onde foi colocado o óleo de imersão. (Santos F., 2003)
Ao microscópio
procure
os bacilos álcool-ácido
resistentes. Que aparecem
sob
a forma
de bastonetes em fundo azul. Podendo ser retos ou ligeiramente curvos. Quando a coloração avermelhada estiver distribuída igualmente
- bacilos sólidos;
quando
de forma
desigual - bacilos fragmentados
ou granulosos. Já os bacilos em forma de cachos são chamados de “globias”. Presença de Bacilos sólidos estão relacionados com presença de micro-organismos viáveis e podem ser vistos nos casos novos, ainda não tratados ou nas recidivas. (http://www.plugbr.net/index.php?tag=cient%C3%ADfi cos)
Figura 2 - Tuberculose meníngea circunscrita em paciente soro-positivo.
 |
| Fonte: http://anatpat.unicamp.br/nptneurotbc2.html |
VI).Como reportar o resultado:
Resultado negativo: Não foram observados bacilos álcool ácido resistentes na amostra analisada. Resultado positivo: consultar
os itens abaixo:
* 1 a 2 bacilos em 300 campos. ---Confeccionar nova lâmina(1+)
* 1 a 9 BAAR em 100 campos microscópicos (2+)
* 1 a 9 BAAR em 10 campos microscópicos (3+)
* 1 a 9 BAAR por campo microscópico (4+)
* >
9 BAAR por campo microscópico
Se o resultado
persistir,
pedir nova amostra para confirmar o
resultado
VII).Comentários:
Especificidade – essa coloração não é específica para micobactérias, desde que
outros
microrganismos podem apresentar propriedade álcool-ácido resistente, tais como Nocardia spp., Rodococcus spp. e
Legionellla
micdadei
Sensibilidade – varia de 22 a 81%,
o que significa que um resultado negativo não exclui a presença de micobactérias na amostra. São necessários em geral 104 microrganismos por mililitro de escarro
para obtermos um
resultado positivo pelo exame direto. Em amostras de urina e lavado gástrico
devem ser sempre acompanhadas de cultura.
Figura 3 - Heinrich Hermann Robert Koch, em 1882 descobriu o bacilo da tuberculose (Bacilo de Koch).
Figura 3 - Heinrich Hermann Robert Koch, em 1882 descobriu o bacilo da tuberculose (Bacilo de Koch).
 |
| Fonte: http://historiaybiografias.com/koch/ |
VIII).Referências bibliográficas:
- Campinas et. al. - Tuberculose – Manual de orientação / Divisão de tuberculose/
Centro de Vigilância
Epidemiológica. 2002
- Oplustil, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Procedimentos Básicos em Microbiologia Clínica, 3ª
Ed. Sarvier, São Paulo, SP, 2010.
- Santos, F. L. Manual de Microbiologia Clínica. 3ª Edição, Ed. Universitária, João Pessoa, PB, 2003.
- http://www.plugbr.net/index.php?tag=cient%C3%ADficos
- https://edutec.unesp.br/publicador/index.php/conteudo/visualizar?pid=291&Conteudo_page=17 Acesso em 26 de Agosto de 2016.
- http://anatpat.unicamp.br/nptneurotbc2.html Acesso em 26 de Agosto de 2016.
- https://edutec.unesp.br/publicador/index.php/conteudo/visualizar?pid=291&Conteudo_page=17 Acesso em 26 de Agosto de 2016.
- http://anatpat.unicamp.br/nptneurotbc2.html Acesso em 26 de Agosto de 2016.


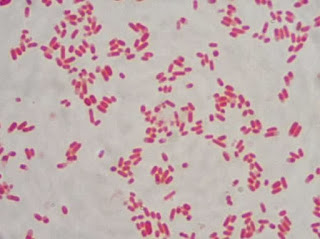
BAAR/Bacilos álcool-ácido resistentes: coradas em rosa (coram-se pela fucsina fenicada e resistem a descoloração pelo álcool-ácido).
ResponderExcluirBactérias NÂO ácool-ácido resistentes: coradas em azul (coram-se pelo azul de metileno, corante contrastante).