7. GRAM
Como referenciar esta página: Nanes-Lima, Z.; Vieira, R.C.R., Silva, L.S. Gram. Detalhes Microbiológicos, Campina Grande, 10 nov. 2025. Disponível em: https://microimunoliga.blogspot.com/2016/08/pratica-7_3.html  |
| Hans Christian Joachin Gram, em 1884 desenvolveu a técnica de coloração de Gram Fonte: https://flavioehedranbioifes.wordpress.com/ |
(Microbiologia Básica / Profa . Zilka Nanes Lima)
Página atualizada em 10/11/2025
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.
COLORAÇÃO DE GRAM
1.Princípio : A coloração de Gra m s erve para um diagnós tico rápido pres untivo de um agente infecc ios o e també m para avaliar a qualidade da a mos tra para cultura. O Gra m c las s ifica as bactérias com bas e na morfologia e a fin idade pelos corantes em Gra m-pos itivas (ro xas ) e Gra m-negativas (ros as ).
2.Materiais clínicos que podem s er utilizados :
Amos tras recebidas em s wabs , a mos tras obtidas após as piração, frag mentos de tecido e bióps ias , líquidos orgânicos em geral (líquor, líquido
s inovial, líquido
as cítico,
líquido
pleura l),
s ecreções em geral (uretra l, vaginal,orofaringe, nas al, etc), fe zes e a mos tras de urina.
PS: O Gra m ta mbé m pode s er realizado a partir do cres ci mento de mic ro-organis mos e m me ios s ólidos ou líquidos .
3.Procedimento:
3.1 Preparo do es fregaço para Gram:
- Es fregaços de colônias : Colocar u ma pequena gota de s olução fis iológica s obre a lâ mina, co m u ma a lça ou fio bacteriológico, tocar na s uperfíc ie de u ma co lônia is olada e e muls ionar gentilmente na gota colocada s obre a lâ mina. Deixar s ecar ao ar e fixar no calor brando.
-Esfregaços provenientes de meios de cultura líquidos: Transferir uma amostra com alça bacteriológica para uma lâmina. Deixar secar ao ar e fixar pelo calor brando.
- Amostras recebidas em “Swabs ” – Rolar o swab delicada mente s obre a superfície de u ma lâmina limpa . Deixar s ecar ao ar e fixa r no calor brando.
-Amostras de urina:
1. Urina de jato médio:
- Homogeneizar o material e depositar 10 μL em uma lâmina, sem espalhar.
- Deixar secar ao ar e fixar no calor.
2. Urina de 1º jato:
-Centrifugar 1.500 rpm/5 min.
-Retirar o sobrenadante e colocar uma gota do sedimento em uma lâmina demarcada, sem espalhar.
- Deixar secar ao ar e fixar pelo calor brando.
- A mos tras de aspirado, e xs udatos , es carro e fezes : Se co m pouca vis cos idade, homogeneizar e fa ze r o esfregaço. Se es pes sa, dilu ir e m s olução fisiológ ica es téril antes . Deixar s ecar ao ar e fixar no ca lor.
Figura 1 - Esquema de confecção do esfregaço a ser corado pelo Gram.
 |
| Fonte: Nanes-Lima (Arquivo pessoal) |
3.2 Co loração de Gra m:
1. Confeccionar o es fregaço, fixar o es fregaço na chama do bico de Buns en;
2. Dis por as lâ minas em u m s uporte não muito pró ximo u ma de outra;
3. Cobrir o es fregaço co m papel de filtro (modificação da autora);
4. Cobrir o papel de filtro co m cris tal violeta e de ixa r por 1 minuto;
5. Lavar co m água corrente, retirando o papel de filtro e o e xces s o do corante;
6. Cobrir o es fregaço co m Lugol fraco por 1 minuto;
7. Lavar co m água corrente;
8.
Desc orar com álcool-acetona, prime iro cobrindo o es fregaço deitado no s uporte durante 5 segundos , e depois gotejando a lâmina inclinada até que não es corra mais o cris tal violeta (cuidado para não descorar demais ). PS: Pode s e utilizar apenas álcool a 95% .
9. Lavar co m água corrente;
10. Cobrir co m fucsina ou safranina por 30 segundos diluidas
1/10 (s e o corante for novo deixa r u m tempo ainda menor)
11. Lavar co m água corrente;
12. Caso o verso da lâmina (o lado que não está com o esfregaço) ainda esteja sujo de corantes, passar um papel absorvente com descorante;
13. Deixar a lâmina em pé em uma estante, ou encostada na parede encima da bancada, para secar ao ar;
12. Caso o verso da lâmina (o lado que não está com o esfregaço) ainda esteja sujo de corantes, passar um papel absorvente com descorante;
13. Deixar a lâmina em pé em uma estante, ou encostada na parede encima da bancada, para secar ao ar;
14. Exa minar ao mic ros cópio.
Vídeo: Técnica de coloração de Gram
Fonte: https://www.youtube.com/watch?v=0zq9ra_YUGQ
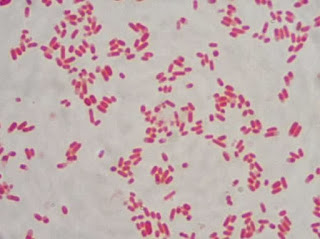
Figura 4 - Bactérias Gram-positivas se coram em roxo e bactérias Gram-negativas se coram em rosa.
Figura 2 - Esquema da coloração de Gram.
 |
| Fonte: ebah |
Figura 3 - Passo a passo da Coloração de Gram.
 |
| Fonte: Nanes-Lima (Arquivo pessoal) |
Vídeo: Técnica de coloração de Gram
Figura 4 - Bactérias Gram-positivas se coram em roxo e bactérias Gram-negativas se coram em rosa.
 |
| Fonte: http://www.farmaceuticacuriosa.com/2015/03/coloracao-de-gram.html |
4. Co mo reportar o res ultado:
GRAM : Em alguns materia is clínicos é importante avaliar s ua qualidade. Co m objetiva de 10x ava lia r a qualidade do materia l c línico e es fregaço, verificando pres ença de leucócitos e células epitelia is . Co m objet iva de imers ão de 100x (au mento de 1.000x), analis ar várias áreas do es fregaço e re latar a aus ência ou pres ença de micro-organismos , quantificando segundo a tabela 1 e c las s ificando conforme des crito a s eguir:
Des crição da morfologia e agrupa mento dos mic ro -organis mos obs ervados :
-Cocos Gra m-pos itivos aos pares
-Cocos Gra m-pos itivos em cadeias
-Cocos Gra m- pos itivos agrupados
-Bas tonetes ou Bacilos Gra m-pos itivos
- Bas tonetes ou Bacilos Gra m-pos itivos ramificados
-Bas tonetes ou Bacilos Gra m-pos itivos corineifo rmes ou difteróides
-Bac ilos gram-pos itivos tipo Döderlein
-Diplocococos Gra m-negativos
-Bas tonetes ou Bacilos Gra m-negativos
-Cocobacilos Gra m-negativos
-Cocobacilos Gra m-variáveis
-Leveduras e/ou leveduras em brota mento e/ou com fo rmação de pseudohifas .
Tabela 1 – Orientação simplificada para a leitura das lâminas coradas pelo método de Gram
(s uges tão de quantificação)
(s uges tão de quantificação)
Clas s ificaão numérica
|
Class ificação desscritiva
|
Média do número de bactérias /10 ca mpos observados com au mento de 1.000x
|
0
|
Aus entes
|
0
|
1+
|
Raros
|
1-5
|
2+
|
Alguns ou poucos
|
6-15
|
3+
|
Frequentes
|
16-30
|
4+
|
Nu meros os
|
>30
|
Fonte: Oplustil et.al., 2004
Em alguns casos é importante reportar também no resultado a celularidade, por exemplo, em materiais normalmente estéreis, amostras do trato respiratório inferior e amostras do trato genital.
5.Comentários : Para v is ualizar micro -organis mos pelo método de Gra m,em amostras de urina em gera l é necessária a presença de cerca de 104UFC/ mL (ou col/ mL) .
- Limite de detecção para amostras de urina segundo a ANVISA; ≥ 1 bactéria em campo de imersão
≥ 105 UFC/ml
Em alguns casos é importante reportar também no resultado a celularidade, por exemplo, em materiais normalmente estéreis, amostras do trato respiratório inferior e amostras do trato genital.
5.Comentários : Para v is ualizar micro -organis mos pelo método de Gra m,em amostras de urina em gera l é necessária a presença de cerca de 104UFC/ mL (ou col/ mL) .
- Limite de detecção para amostras de urina segundo a ANVISA; ≥ 1 bactéria em campo de imersão
≥ 105 UFC/ml
Um res ultado negativo não s ignifica obrigatoriamente aus ência de mic ro -organis mos naquela a mos tra e deve s er confirmado co m a cultura. Lembrar que se não houver crescimento na cultura não significa obrigatoriamente ausência de micro-organismos em determinado material clínico.
6. Manuseio do microscópio óptico para leitura de esfregaços corados pelo Gram:
6.1 Selecionar a objetiva de 10x e baixar completamente a platina;
6.2 Colocar a lâmina sobre a platina e prendê-la corretamente; verificar a intesidade da luz e, se necessário, ajustar;
6.3 Iniciar a observação com a objetiva de 10x;
6.4 Para focalizar:
- Realizar os primeiros movimentos com o micrométrico.
- Assim que conseguir encontrar o foco, colocar uma gota de óleo de imersão e passar para a objetiva de 100x.
- Utilizar agora o micrométrico até conseguir a focalização desejada. Aumentar ou diminuir a intensidade da luz para melhorar a visualização das estruturas.
6.5 Após utilizar a objetiva com óleo de imersão, limpá-la com panos especiais para lentes, como papel de óptica ou papel de filtro, passando o papel suavemente somente em um sentido. Caso o óleo de imersão seque na objetiva, limpar com álcool:acetona (7:3) ou xilol. Não utilizar solventes excessivamente, pois podem danificar as lentes.
Figura 5a - Esfregaço confeccionado a partir do líquor oriundo de uma paciente de 61 anos com sintomatologia de meningite bacteriana; e corado pela técnica de Gram.
Em objetiva de imersão (100x), observamos diplococos Gram-negativos, sugestivos de Neisseria spp.
 |
| Fonte: contribuição da Biomédica Niedja Eloi (2016) |
Figura 5a - Esfregaço confeccionado a partir do líquor oriundo de uma paciente de 61 anos com sintomatologia de meningite bacteriana; e corado pela técnica de Gram. Em objetiva de imersão (100x); observamos diplococos Gram-negativos, intracelulares e intracelulares sugestivos de Neisseria spp.
 |
| Fonte: contribuição da Biomédica Niedja Eloi (2016) |
6. Manuseio do microscópio óptico para leitura de esfregaços corados pelo Gram:
6.1 Selecionar a objetiva de 10x e baixar completamente a platina;
6.2 Colocar a lâmina sobre a platina e prendê-la corretamente; verificar a intesidade da luz e, se necessário, ajustar;
6.3 Iniciar a observação com a objetiva de 10x;
6.4 Para focalizar:
- Realizar os primeiros movimentos com o micrométrico.
- Assim que conseguir encontrar o foco, colocar uma gota de óleo de imersão e passar para a objetiva de 100x.
- Utilizar agora o micrométrico até conseguir a focalização desejada. Aumentar ou diminuir a intensidade da luz para melhorar a visualização das estruturas.
6.5 Após utilizar a objetiva com óleo de imersão, limpá-la com panos especiais para lentes, como papel de óptica ou papel de filtro, passando o papel suavemente somente em um sentido. Caso o óleo de imersão seque na objetiva, limpar com álcool:acetona (7:3) ou xilol. Não utilizar solventes excessivamente, pois podem danificar as lentes.
Referências:
- Módulo 1 da Anvisa (Agência Nacional de Vigilânica Sanitária): Principais Sídromes Infecciosas.
http://www.anvisa.gov.br/servicosaude/manuais/microbiologia/mod_1_2004.pdf Acesso em 25 de Setembro de 2016.
- Oplus til, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Proce di mentos Bás icos em Micr obiol ogia Clínica,
Ed. Sarvier, 3ª edição. São Paulo, SP, 2010.
- Oplus til, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Proce di mentos Bás icos em Micr obiol ogia Clínica,
Ed. Sarv ier, 2ª edição. São Paulo, SP, 2004.
- http://www.kasvi.com.br/uso-limpeza-microscopio-optico/ Acesso em 06 de Setembro de 2016.
-Conhecimento adquirido.
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
- Módulo 1 da Anvisa (Agência Nacional de Vigilânica Sanitária): Principais Sídromes Infecciosas.
http://www.anvisa.gov.br/servicosaude/manuais/microbiologia/mod_1_2004.pdf Acesso em 25 de Setembro de 2016.
- Oplus til, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Proce di mentos Bás icos em Micr obiol ogia Clínica,
Ed. Sarvier, 3ª edição. São Paulo, SP, 2010.
- Oplus til, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Proce di mentos Bás icos em Micr obiol ogia Clínica,
Ed. Sarv ier, 2ª edição. São Paulo, SP, 2004.
- http://www.kasvi.com.br/uso-limpeza-microscopio-optico/ Acesso em 06 de Setembro de 2016.
-Conhecimento adquirido.
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.
É permitido compartilhar o conteúdo com crédito às autoras, sem uso comercial e sem modificações.

Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!