3. FUNGOS FILAMENTOSOS
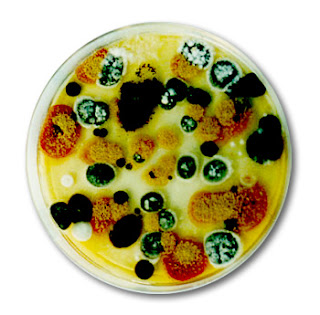 |
| Fonte: http://reinofungi1.blogspot.com.br |
MICOLOGIA
(Parte 2 – Prática de Fungos Filamentosos)
(Microbiologia Básica / Profa . ZilkaNanes Lima)
Copyright ZILKA NANES LIMA © 2016
Copyright ZILKA NANES LIMA © 2016
A. ISOLAMENTO DE FUNGOS DO AR
- Finalidade: O isolamento de fungos
anemófilos é importante na determinação da microbiota do ar de uma área,
nos estudos sobre alergia a fungos, na determinação do grau de
contaminação de ambientes, para obtenção de amostras de interesse
industrial, etc.
- Fundamento:
Usando-se a técnica de exposição de placas com meio de cultura durante
tempos pré-fixados, os esporos em flutuação no ar sedimentam sobre o meio
e ai germinam.
- Material:
a. Placa com ágar Sabouraud ou ágar batata dextrose.
b. Lactofenol azul algodão
c. Lâminas, lamínulas, alças,
etc.
d. Tubos com
ágar-Sabouraud ou ágar batata inclinado.
4. Execução da técnica:
a. Abrir a placa e expor durante 20 minutos
b. Fechar, identificar e
incubar à temperatura ambiente com a tampa pra cima
c. Acompanhar o
desenvolvimento das culturas
(deixar
15 dias incubado à temperatura ambiente)
d. Analisar a
macromorfologia das colônias fúngicas
e. Repicar em tubos para isolamento e posterior realização de
microcultivo
5. Resultados
B. TÉCNICAS PARA IDENTIFICAÇÃO DE
FUNGOS FILAMENTOSOS
B.1- Técnica de esgarçamento:
Utilizada
como primeira tentativa (mais rápida) para identificação de colônias filamentosas.
As estruturas fúngicas são quebradas, tornando-se mais difícil a identificação.
· Com alça de platina em “L”,
retirar um pedaço da colônia de bolor crescida no ágar.
· Colocar 1 a 2 gotas de Lactofenol
azul-algodão. Cobrir com lamínula, comprimindo levemente. Observar em
microscópio com aumento de 400X.
B.2 - Microcultivo em lâmina:
No
microcultivo em lâmina, as estruturas permanecem íntegras além de ser utilizado
um meio de cultura (ágar batata), que estimula a produção de macro e microconídeos,
que na maioria das vezes identificam o fungo. Estimula, também, a formação de
pigmento.
Esterilizar placas de Petri com 3 lâminas no interior (duas servem para
suporte e a outra para realizar o microcultivo).
· Preparar ágar batata em
placa
· Cortar em quadradinhos
· Colocar um pedaço de ágar batata
no centro da lâmina do microcultivo
· Com a alça em “L”, cortar pedaços
bem pequenos da colônia do bolor, crescidos no ágar e colocar nos quatro lados
do pedaço de ágar batata
· Cobrir com lamínula estéril,
pressionando levemente
. Colocar um pouco de água
destilada estéril e deixar á 25O C, repondo a água estéril, sempre
que necessário. Deixar por 10-15 dias, dependendo da velocidade do crescimento
do fungo.
· Para montar, retirar a lamínula com
pinça estéril. Fixar o fungo na lamínula colocando 1 a 2 gotas de álcool e
esperar secar. Montar essa lamínula em lâmina limpa, com uma gota de lactofenol
azul-algodão.
. A lamínula pode ser vedada com
esmalte de unha ou Entellan para conservar por mais tempo.
Professora Zilka Nanes Lima (Microbiologia e Imunologia Clínica)
MICROBIOLOGIA BÁSICA
Fonte: Apostila de Micologia Clínica (Professor Sandro
Rogério de Almeida – Faculdade de Ciências Farmacêuticas da Universidade de São
Paulo)
 |
| Anverso de colônia de fungo filamentoso. Fonte: Lima, 2018. (Arquivo pessoal da autora) |
 |
| Reverso de colônia de fungo filamentoso. Fonte: Lima, 2018. (Arquivo pessoal da autora) |

Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!