18. INTERPRETANDO O ANTIBIOGRAMA
Como referenciar esta página: Nanes-Lima, Z.; Vieira, R.C.R., Silva, L.S. Interpretando o antibiograma. Detalhes Microbiológicos, Campina Grande, 09 nov. 2025. Disponível em: https://microimunoliga.blogspot.com/2018/07/18-interpretando-o-antibiograma.html
 |
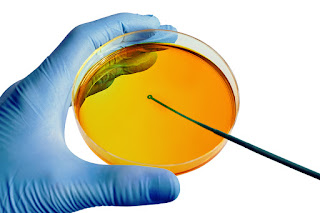
| Antibiograma da enterobactéria Salmonella spp. Fonte: Nanes-Lima (Arquivo pessoal) |
Página atualizada em 09/11/2025
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.
Atividade prática: ANTIBIOGRAMA
(Método Kirby-Bauer)
PRIMEIRO DIA:
- Confeccionar o antibiograma
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
- Preparar uma suspensão bacteriana-padrão equivalente a 0,5 da escala
de McFarland que corresponde a aproximadamente 1 x 108 UFC/mL e que
pode ser obtido pelo método da suspensão direta ou método de crescimento. Essa
etapa é crítica e deve ser seguida conforme as recomendações para a obtenção de
resultados confiáveis.
- No método da suspensão direta com o auxílio de alça ou agulha
bacteriológica tocar na superfície de três a quatro colônias com a mesma
morfologia e suspender em 3 a 4 mL de solução fisiológica estéril, caldo
Mueller Hinton ou caldo TSB.
(Preparo do inóculo) - Comparar o inóculo ajustado com a escala de MacFarland colocando os
tubos lado a lado contra um cartão de fundo preto com tiras brancas. Os tubos
devem ter a mesma dimensão/diâmetro, para serem comparados.
- Se a turbidez ultrapassar a escala ajustar com solução fisiológica
estéril.
(Inoculação nas placas) - Dentro de 15 minutos após o ajuste do inoculo, proceder à semeadura
introduzindo um swab estéril na
suspensão padronizada.
- Comprimir o swab na parede
interna do tubo para retirar o excesso do inoculo e semear na superfície do
ágar Mueller Hinton em três direções.
- Deixar a placa semeada tampada por 5 minutos e não mais de 15 minutos
à temperatura ambiente, para que o inóculo seja completamente absorvido pelo
ágar antes de aplicar os discos.
(Aplicação dos discos) - A distância entre um disco e outro dever ser no
mínimo de 24 mm. Colocar no máximo 12
discos em placas de 150 mm e não mais que 5 em placas de 90 mm.
- Após a colocação dos discos, pressionar levemente a superfície de cada
disco com o auxílio de uma pinça.
- Uma vez o disco colocado, não remover do lugar, pois a difusão da
droga é imediata.
(Incubação das placas) - Incubar as placas invertidas em, no máximo, 15 minutos após a
colocação dos discos.
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
- Incubar em ar ambiente. A temperatura máxima da
estufa dever estar aferida em 35 ± 1oC, e de 33-35oC para
testes com disco de oxacilina e cefoxitina para Staphylococcus spp.
- O tempo de incubação deve ser de 18±2 horas. (Exceções:
vide Oplustil et. al.; BrCAST 2025, CLSI M100-S30)
SEGUNDO
DIA: - A interpretação dos resultados é feita medindo-se
os halos de inibição do crescimento bacteriano nas placas semeadas na aula
passada, ao redor dos discos. A medida é realizada com paquímetro, régua
escolar transparente e anotada em milímetro (mm).
- Os halos
de inibição para cada antimicrobiano testado devem ser interpretados nas
categorias sensível, intermediário ou resistente, de acordo com critérios
estabelecidos nas tabelas do BrCAST (EUCAST), em português disponível em: www.brcast.org.br - “The Brazilian
Commitee on Antimicrobial Susceptibility Testing” e CLSI M100-S30 (Clinical Laboratory Standards Institute).
ANTIBIOGRAMA (Método
Kirby-Bauer)
Microrganismo testado: ______________________________________________
Antibiótico
|
Código
|
Conc. (µg)
|
Ponto de
corte
Diamêtro do halo (mm)
S ≥ I R <
|
Tamanho do halo
|
Interpretação
|
|||
Gentamicina
|
GEN
|
10
|
17
|
14-16
|
14
|
|||
Cefoxitina
|
CFO
|
30
|
-
|
-
|
-
|
------------------
|
Somente
interpretação para CIM no BrCAST.
|
|
Aztreonam
|
ATM
|
30
|
24
|
-
|
21
|
|||
Cloranfenicol
|
CLO
|
30
|
17
|
-
|
17
|
|||
Ceftriaxona
|
CRO
|
30
|
23
|
20-22
|
20
|
|||
Tetraciclina
|
TET
|
30
|
-
|
-
|
-
|
-----------------
|
Não
aplicável segundo BrCAST.
|
|
- Padrões interpretativos segundo documento do
BrCAST para Enterobacterales
- Tamanho do halo deve ser anotado em milímetros
(mm).
- Interpretação: S= sensível /I=sensível, aumentando exposição / R=resistente
Microrganismo testado: ______________________________________________
Antibiótico
|
Código
|
Conc. (µg)
|
Sensível
|
Intermediário
|
Resistente
|
Tamanho
do halo
|
Interpretação
|
Gentamicina
|
GEN
|
10
|
≥ 15
|
13-14
|
≤ 12
|
||
Cefoxitina
|
CFO
|
30
|
≥ 18
|
15-17
|
≤ 14
|
||
Aztreonam
|
ATM
|
30
|
≥ 21
|
18-20
|
≤ 17
|
||
Cloranfenicol
|
CLO
|
30
|
≥ 18
|
13-17
|
≤ 12
|
||
Ceftriaxona
|
CRO
|
30
|
≥ 23
|
20-22
|
≤ 19
|
||
Tetraciclina
|
TET
|
30
|
≥ 15
|
12-14
|
≤ 11
|
- Padrões
interpretativos segundo documento do CLSI M100-S30 para Enterobacterales
- Tamanho
do halo deve ser anotado em milímetro (mm).
-
Interpretação: S= sensível / I=sensível, aumentando exposição / R=resistente
Referências:
1. Oplustil, C.P.; Zoccoli, C.M.; Tobouti, N.R.; Sinto, S.I. Procedimentos Básicos em Microbiologia Clínica, 3ª Edição. Ed. Sarvier, São Paulo, SP, 2010.
2. BrCAST 2025 - https://brcast.org.br/documentos/documentos-3/
3. CLSI 2018 (M-100 S-27) - chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.nih.org.pk/wp-content/uploads/2021/02/CLSI-2020.pdf
4. Levinson, W. Microbiologia Médica e Imunologia. 13a Edição. Ed. ArtMed. Porto Alegre – RS, 2016.
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025). Atribuição-NãoComercial-SemDerivações.
É permitido compartilhar o conteúdo com crédito às autoras, sem uso comercial e sem modificações.
Creative Commons(by-nc-nd) ZILKA NANES LIMA(2025).
Atribuição-NãoComercial-SemDerivações.

Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!