17. ANTIBIOGRAMA PELA TÉCNICA DE KIRBY-BAUER
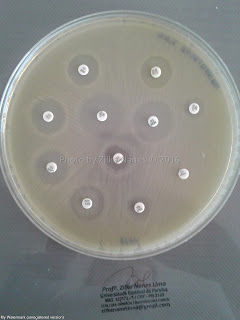 |
| Antibiograma de enterobactéria pela técnica de Kirby-Bauer Fonte: Autora (arquivo pessoal) |
ANTIBIOGRAMA
(TESTE DE SENSIBILIDADE AOS ANTIMICROBIANOS)
- INTRODUÇÃO:
A realização e a interpretação do
teste de sensibilidade aos antimicrobianos (TSA) é uma das principais e
desafiadoras tarefas do laboratório de microbiologia, seja pelas limitações dos
testes utilizados, como, por exemplo, as encontradas no teste de Kirby e Bauer
e automação, seja pela detecção cada vez mais crescente de novos mecanismos de
resistências.
Um
dos princípios básicos, comum a todas as metodologias, é a realização do teste
em bactérias isoladas de amostras clínicas representativas de um processo
infeccioso, no qual a sensibilidade aos antimicrobianos não é previsível.
- SELEÇÃO
DOS ANTIMICROBIANOS A SEREM TESTADOS:
O laboratório tem a responsabilidade de testar e
reportar os antimicrobianos mais apropriados para o micro-organismo isolado e o
sítio de infecção.
As orientações sobre os antimicrobianos mais adequados
para cada grupo de microrganismos (aeróbios e fastidiosos), as recomendações
detalhadas de como realizar a metodologia e a interpretação dos testes são
publicadas e atualizadas periodicamente por organizações especializadas. A
grande maioria dos laboratórios brasileiros segue as recomendações padronizadas
pelo BrCAST, Brazilian Committee on Antimicrobial Susceptibility Testing http://brcast.org.br/documentos/ ,
sendo que alguns laboratórios ainda adotam o documento do CLSI (Clinical and Laboratory Standards Institute (USA), pdf CLSI M100-S25
- MATERIAL
CLÍNICO:
Para realizar os testes de sensibilidade aos
antimicrobianos é necessário um isolado bacteriano viável de cultura recente a
ser testada e um grupo de antimicrobianos mais indicado de acordo com o tipo de
bactéria e o material clínico do seu isolamento.
Observação: Para monitorar a precisão e acurácia dos
procedimentos aplicados no TSA e verificar a qualidade dos materiais empregados
e a competência dos colaboradores na realização das várias etapas do teste
utilizamos controle de qualidade. Para o controle devem ser utilizadas
cepas-padrões de coleções como ATCC – American
Type Culture Collection.
Tabela 1. Mecanismo de ação de alguns antibióticos
MODO DE AÇÃO
|
ANTIBIÓTICOS
|
Parede celular
|
Penicilina, cefalosporina, cefamicinas,
monolactâmicos, bacitracina, fosfomicina, vancomicina
|
Membrana citoplasmática
|
Anfotericina B, Nistatina, Polimixinas, Tirotricina
|
Ácidos nucleicos
|
Griseofulvina, Rifampicina, Quinolonas.
|
Síntese Proteíca
- Inibindo a síntese
- Formação de proteínas defeituosas
|
Clindamicina, Cloranfenicol, Eritromicina,
Lincomicina, Tetraciclina.
Amicacina, Canamicina, Estreptomicina, Gentamicina,
Neomicina, Tobramicina.
|
- PRÁTICA
(EM DUAS PARTES):
4.1.
PRIMEIRA AULA (Método da difusão do disco descrito por
Kirby e Bauer em 1966)
4.1.1.
MATERIAL NECESSÁRIO:
- Cultura em meio sólido dos microrganismos a serem
testados (Gram-positivo: Staphylococcus
aureus, Gram-negativa: Escherichia
coli)
- Lâminas de microscopia
- Alça de platina
- Bateria de coloração de Gram
- Dois swabs esterilizados
- Duas placas de Petri contendo meio para antibiograma
(ágar Mueller Hinton)
- Uma pinçab
- Discos de antibióticos.
4.1.2. PROCEDIMENTOS:
- Fazer um esfregaço da cultura a ser utilizado, corar
pelo método de Gram (cultura pura do microrganismo em meio sólido, com 24 horas
de incubação). A finalidade da lâmina é observar a morfologia e características
de coloração, para orientar a escolha dos antibióticos a serem testados.
- Preparar uma suspensão bacteriana-padrão equivalente
a 0,5 da escala de McFarland que corresponde a aproximadamente 1 x 108
UFC/mL e que pode ser obtido pelo método da suspensão direta ou método de
crescimento. Essa etapa é crítica e deve ser seguida conforme as recomendações
para a obtenção de resultados confiáveis.
- No método da suspensão direta com o auxílio de alça ou
agulha bacteriológica tocar na superfície de três a quatro colônias com a mesma
morfologia e suspender em 3 a 4 mL de solução fisiológica estéril, calo Mueller
Hinton ou caldo TSB.
(Preparo do inoculo)
- Comparar o inóculo ajustado com a escala de
MacFarland colocando os tubos lado a lado contra um cartão de fundo preto com
tiras brancas. Os tubos devem ter a mesma dimensão/diâmetro, para serem
comparados.
- Se a turbidez ultrapassar a escala, ajustar com
solução fisiológica estéril.
(Inoculação nas placas)
- Dentro de 15 minutos após o ajuste do inoculo,
proceder à semeadura introduzindo um swab
estéril na suspensão padronizada.
- Comprimir o swab
na parede interna do tubo para retirar o excesso do inoculo e semear na
superfície do ágar Mueller Hinton em três direções.
- Deixar a placa semeada tampada por 5 minutos e não
mais de 15 minutos à temperatura ambiente, para que o inóculo seja completamente
absorvido pelo ágar antes de aplicar os discos.
(Aplicação dos discos)
- A distância entre um disco e outro dever ser no
mínimo de 24 mm. Colocar no máximo 12 discos
em placas de 150 mm e não mais que 5 em placas de 90 mm.
- Após a colocação dos discos, pressionar levemente a
superfície de cada disco com o auxílio de uma pinça.
- Uma vez o disco
colocado, não remover do lugar, pois a difusão da droga é imediata.
(Incubação das
placas)
- Incubar as placas
invertidas em, no máximo, 15 minutos após a colocação dos discos.
- Incubar em estufa
aeróbia.
- A temperatura
máxima da estufa dever estar aferida em 35 ± 2oC, e em 33-35oC
para testes com disco de oxacilina e cefoxitina para Staphylococcus spp.
- O tempo de
incubação deve ser de 16 a 18 horas (exceções: vide Oplustil et. al.)
4.2.
SEGUNDA AULA (Interpretação dos resultados):
4.2.1.
A interpretação dos
resultados é feita medindo-se os halos de inibição do crescimento bacteriano
nas placas semeadas na aula passada, ao redor dos discos. A medida é realizada
com paquímetro, régua escolar transparente e anotada em milímetro (mm).
4.2.2.
Os halos de inibição
para cada antimicrobiano testado devem ser interpretados nas categorias
sensível, intermediário ou resistente, de acordo com critérios estabelecidos
nas tabelas do BrCAST (revisado anualmente). *
Referências bibliográficas:
- Jorge, A.O.C.. Microbiologia: atividades práticas 2a
edição. Ed. Santos. São Paulo, SP, 2008
- Oplustil, C.P.; Zoccoli, C.M.;
Tobouti, N.R.; Sinto, S.I. Procedimentos
Básicos em Microbiologia Clínica 3a
edição.Ed.
Sarvier, São Paulo- SP, 2010.
-*Documento do BrCAST de Janeiro 2018 (Brazilian Committee on Antimicrobial Susceptibility Testing) http://brcast.org.br/documentos/
- Normas de desempenho para Testes de
Sensibilidade Antimicrobiana: 28º Suplemento Informativo. CLSI (Clinical and
Laboratory Standards Institute)., 2018.
- Conhecimento adquirido.

Comentários
Postar um comentário
Olá! Comente abaixo sua opinião a respeito do nosso blog, ajudará a manter nosso projeto ativo. Obrigada!